Glossário
Temperatura Curie
A temperatura na qual ocorre uma transição entre as fases ferromagnética e paramagnética.
Na física e na ciência dos materiais, a temperatura de Curie (TC), ou ponto de Curie, é a temperatura acima da qual os materiais magnéticos perdem suas propriedades ferromagnéticas, sendo substituídos pelo paramagnetismo. O nome da temperatura de Curie é uma homenagem a Pierre Curie (1859-1906), que demonstrou que o magnetismo era perdido em uma temperatura crítica.
Os elementos ferromagnéticos e as ligas com suas temperaturas de Curie - por exemplo
| Material | Temperatura de Curie |
|---|---|
| Fe | 770°C |
| Co | 1115°C |
| Ni | 354°C |
| Gd | 19°C |
| AlNiCo | 850°C |
| Ferrite | 450°C |
| Sm Cobalto | 750 - 825°C |
| Nd-Fe-B | 310 - 340°C |

Você tem alguma pergunta?
Produtos adequados para sua medição
Exemplos de aplicativos
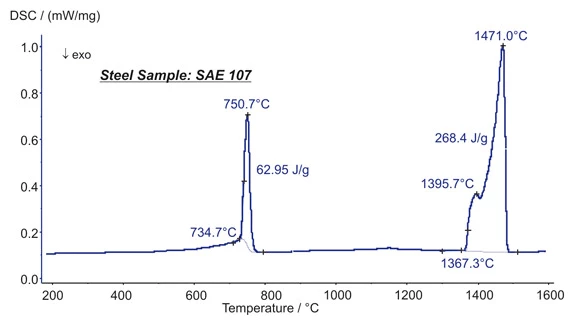
Aqui são apresentadas as energias de transformação de um aço (SAE 107). A 751°C, duas Transições de faseO termo transição de fase (ou mudança de fase) é mais comumente usado para descrever transições entre os estados sólido, líquido e gasoso.transições de fase se sobrepõem uma à outra. O aumento na taxa de fluxo de calor até 735°C se deve à transição Curie (mudança nas propriedades magnéticas). Uma mudança na estrutura cristalina (estrutura bcc para fcc) está causando o pico principal. A mudança estrutural está ligada a uma mudança de entalpia de 63 J/g. ATemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão foi observada a 1367°C (início extrapolado) e ocorreu em duas etapas (picos a 1395°C e 1471°C). O calor deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão foi de 268 J/g. (medição com o DSC 404 F1 Pegasus®®)
Ferro
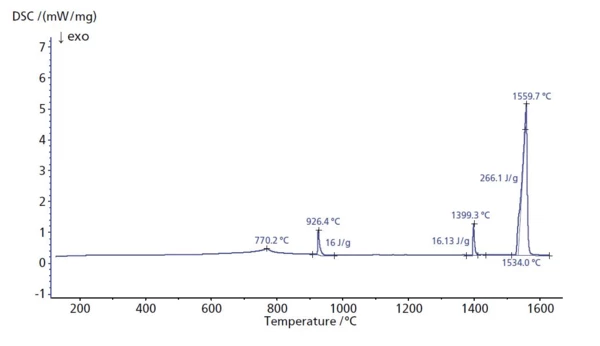
A taxa de fluxo de calor específico do ferro foi medida entre a temperatura ambiente e 1620°C. O pico a 770°C se deve a uma mudança nas propriedades magnéticas do material (a transição de Curie). Nas temperaturas de pico de 926°C e 1399°C, ocorreram duas mudanças na estrutura cristalina. Muito provavelmente devido a impurezas no material, essas temperaturas são ligeiramente deslocadas em comparação com os valores da literatura para ferro puro [1]. ATemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão ocorreu a 1534°C (início extrapolado). O calor deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão foi de 266 J/g. Isso representa um desvio de menos de 1,5% em relação aos valores típicos da literatura para ferro puro.
[1] Das Techniker Handbuch, Grundlagen und Anwendungen der Maschinenbau-Technik, 15. Auflage, Herausgeber Alfred Böge, Vieweg Verlag, 1999