Glossário
Vaporização
A vaporização de um elemento ou composto é uma Transições de faseO termo transição de fase (ou mudança de fase) é mais comumente usado para descrever transições entre os estados sólido, líquido e gasoso.transição de fase da fase líquida para a fase de vapor. Existem dois tipos de vaporização: evaporação e ebulição.
A evaporação é um fenômeno de superfície e só ocorre no limite de fase entre o líquido e a fase gasosa. Os átomos ou as moléculas da superfície ganham energia dos arredores, superam as atrações de outras moléculas e são vaporizados. A evaporação só ocorre quando a pressão parcial do vapor de uma substância é menor do que a pressão de vapor de equilíbrio.
A ebulição descreve o fenômeno geral da rápida vaporização de um líquido em seu ponto de ebulição. Toda a massa do líquido e todas as moléculas, incluindo o interior e a superfície, ganham energia para mudar para o estado de vapor. A ebulição ocorre quando a pressão de vapor de equilíbrio da substância é maior ou igual à pressão ambiental. A temperatura na qual ocorre a ebulição é a temperatura de ebulição, ou ponto de ebulição. O ponto de ebulição varia de acordo com a pressão do ambiente.
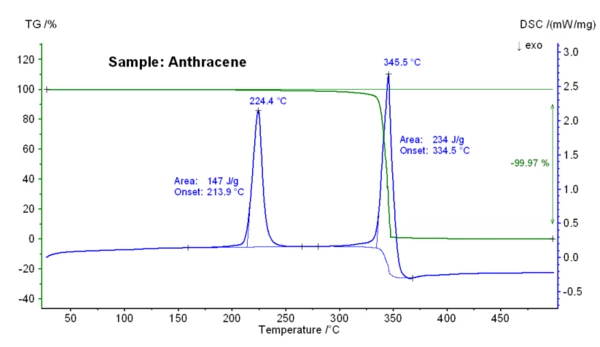
A figura abaixo mostra as alterações de massa dependentes da temperatura e o sinal DSC de uma amostra de antraceno. Em uma temperatura de início extrapolada de 213,9 °C, foi detectado um efeito DSC EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico com uma entalpia de 147 J/g; isso indica aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão do antraceno. Uma etapa de perda de massa de 100% ocorreu entre 250°C e 375°C, resultado da vaporização da amostra. Inicialmente, apenas uma perda de massa small é mostrada pela evaporação da amostra. No entanto, ao atingir a temperatura do ponto de ebulição (início em 334 °C), a evaporação rápida e completa ocorre pela amostra de antraceno em ebulição.
Esta figura mostra as alterações de massa dependentes da temperatura e o sinal DSC de uma amostra de antraceno. Em uma temperatura de início extrapolada de 213,9 °C, foi detectado um efeito DSC EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico com uma entalpia de 147 J/g, o que indica aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão do antraceno. Uma etapa de perda de massa de 100% ocorreu entre 250°C e 375°C, resultado da vaporização da amostra. Inicialmente, apenas uma perda de massa small é mostrada pela evaporação da amostra. No entanto, ao atingir a temperatura do ponto de ebulição (início a 334 °C), a evaporação rápida e completa ocorre ao ferver a amostra de antraceno.