Glossario
Vaporizzazione
La vaporizzazione di un elemento o di un composto è unatransizione di fase dalla fase liquida a quella di vapore. Esistono due tipi di vaporizzazione: l'evaporazione e l'ebollizione.
L'evaporazione è un fenomeno superficiale e si verifica solo al confine di fase tra la fase liquida e quella gassosa. Gli atomi o le molecole in superficie acquistano energia dall'ambiente circostante e vincono l'attrazione di altre molecole e si vaporizzano. L'evaporazione avviene solo quando la pressione parziale del vapore di una sostanza è inferiore alla pressione di equilibrio del vapore.
L'ebollizione descrive il fenomeno della rapida vaporizzazione di un liquido al suo punto di ebollizione. L'intera massa del liquido e tutte le molecole, comprese quelle interne e superficiali, acquistano energia per passare allo stato di vapore. L'ebollizione si verifica quando la pressione di vapore di equilibrio della sostanza è maggiore o uguale alla pressione ambientale. La temperatura alla quale si verifica l'ebollizione è la temperatura di ebollizione, o punto di ebollizione. Il punto di ebollizione varia con la pressione dell'ambiente.
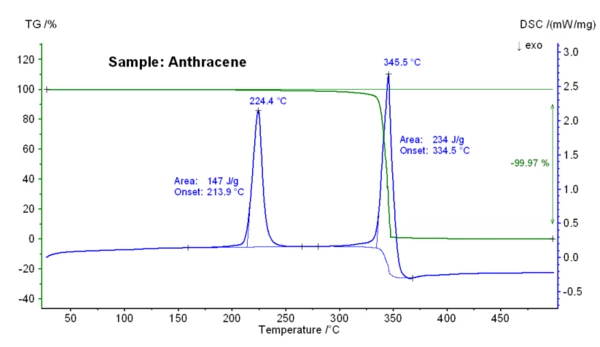
La figura seguente illustra le variazioni di massa in funzione della temperatura e il segnale DSC di un campione di antracene. Alla temperatura di inizio estrapolata di 213,9°C, è stato rilevato un effetto DSC EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con un'entalpia di 147 J/g; ciò indica laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'antracene. Tra 250°C e 375°C si è verificata una perdita di massa del 100%, che è il risultato della vaporizzazione del campione. Inizialmente, l'evaporazione del campione mostra solo una small perdita di massa. Tuttavia, una volta raggiunta la temperatura del punto di ebollizione (334°C), il campione di antracene viene fatto evaporare rapidamente e completamente.
Questa figura illustra le variazioni di massa in funzione della temperatura e il segnale DSC di un campione di antracene. Alla temperatura di inizio estrapolata di 213,9°C, è stato rilevato un effetto DSC EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con un'entalpia di 147 J/g; ciò indica laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'antracene. Tra 250°C e 375°C si è verificata una perdita di massa del 100%, che è il risultato della vaporizzazione del campione. Inizialmente, l'evaporazione del campione mostra solo una small perdita di massa. Tuttavia, una volta raggiunta la temperatura di ebollizione (334°C), l'evaporazione del campione di antracene avviene in modo rapido e completo.