مقدمة
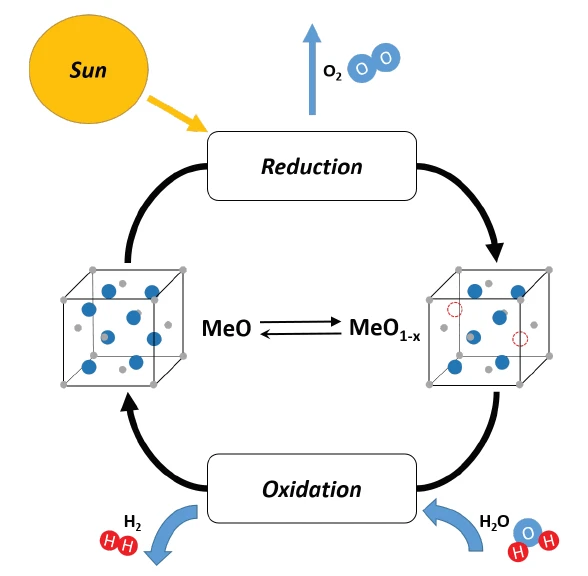
التقسيم الكيميائي الحراري الكيميائي للماء هو عملية تستخدم لإنتاج الهيدروجين باستخدام حرارة عالية الحرارة (500 درجة مئوية إلى 2000 درجة مئوية) وسلسلة من التفاعلات الكيميائية. ويُعاد استخدام المواد الكيميائية المستخدمة في العملية في كل دورة، مما يخلق حلقة مغلقة تستهلك الماء فقط وتنتج الهيدروجين والأكسجين. وبالتالي، فإن إنتاج الهيدروجين الكيميائي الحراري هو بديل صديق للبيئة لأنظمة إنتاج الهيدروجين القائمة على الوقود الأحفوري [1].
شروط القياس
للتحقق من انقسام الماء الكيميائي الحراري الكيميائي على LSC20 (La0.8Sr0.2CoO3)، تم إجراء قياسات الثقل الحراري (TGA) باستخدام NETZSCH STA 449 F3 Jupiter®. وللتفسير الداعم، اقترن المحلل الحراري بالإضافة إلى ذلك بمطياف الكتلة الرباعي الأقطاب NETZSCH QMS Aëolos® Quadro رباعي الأقطاب. يمكن العثور على تجميع مفصل لشروط القياس الدقيقة في الجدول 1.
الجدول 1: معلمات القياس
| المعلمة | انقسام الماء الحراري الكيميائي الحراري على LSC20 |
|---|---|
| الجهاز | جوبيتر STA 449 F3 STA 449 F3 |
| الملحقات | فرن بخار الماء ومولد بخار الماء |
| ناقل العينة | TGA، النوع S |
| بوتقة | صفيحة TGA مصنوعة من Al2O3 بقطر 17 مم |
| وزن العينة | 215.46 مجم عينة مسحوق العينة) |
| برنامج القياس | RT إلى 1200 درجة مئوية، 15 كلفن/دقيقة، 4% H2 في الأرجون 90 دقيقة متساوي الحرارة عند 1200 درجة مئوية، 4% H2 في الأرجون من 1200 درجة مئوية إلى 600 درجة مئوية، 15 كلفن/دقيقة، 4% H2 في الأرجون 30 دقيقة متساوي الحرارة عند 600 درجة مئوية، الأرجون 60 دقيقة متساوي الحرارة عند 600 درجة مئوية، 33% H2Oفي الأرجون 30 دقيقة متساوي الحرارة عند 600 درجة مئوية، الأرجون |
النتائج والمناقشة
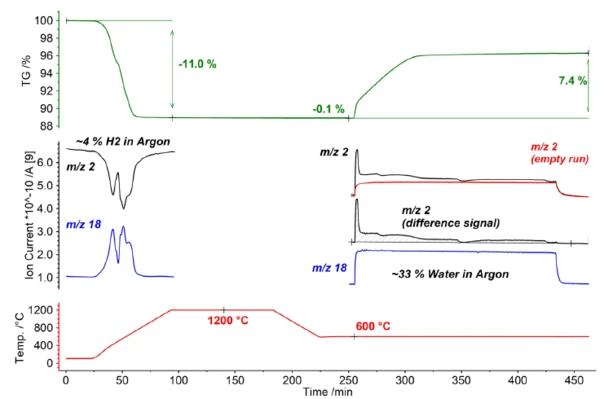
في الخطوة الأولى من الفحص، تم تنشيط LSC20 باستخدام جو مختزل (4% H2 في الأرجون). وبذلك، أظهرت مادة العينة فقدانًا واضحًا للكتلة بنسبة -11.0%. وعلاوة على ذلك، يمكن ملاحظة استهلاك الهيدروجين (الكتلة رقم 2) مع الإطلاق المتزامن للماء (الكتلة رقم 18) بوضوح عن طريق مطياف الكتلة المقترن في وقت واحد (انظر المنحنيات الزرقاء والسوداء في الشكل 2).
يحدث الانقسام الكيميائي الحراري الكيميائي الفعلي للماء في الجزء الثاني من التحقيق. وتحقيقًا لهذه الغاية، بُرِّدت العينة إلى 600 درجة مئوية ثم عُرِّضت لغلاف جوي غازي يحتوي على الماء (33% H2Oفي الأرجون). نتج عن ذلك زيادة في الكتلة المستحثة أكسدة بنسبة 7.4% مع إطلاق الهيدروجين في الوقت نفسه (انظر الكتلة رقم 2 في الشكل 2). استنادًا إلى التغيرات المفاجئة في منحنى الكتلة وكذلك منحنى التيار الأيوني لمطياف الكتلة، يمكن ملاحظة أن انقسام الماء عملية متعددة المراحل؛ وهذا يشير إلى تفاعل سطحي مباشر كخطوة تفاعل أولية بالإضافة إلى تفاعل متحكم فيه بالانتشار في المسار اللاحق.
الملخص
يوفر مفهوم النظام الأساسي لجهاز NETZSCH STA 449 F3 Jupiter® أساسًا ممتازًا لتكرار العمليات والظواهر الحرارية المعقدة. في المثال المعروض، تم بنجاح استنساخ تحقيق مستهدف لتفاعل كيميائي حراري كيميائي لتقسيم الماء باستخدام فرن بخار الماء المصمم خصيصًا ومولد بخار.
ولم يقتصر الأمر على قياس التغيرات في الوزن بدقة (تسجيل الجاذبية) في هذا المثال فحسب، بل تم أيضًا تحليل وتفسير العمليات التي تحدث أثناء التفاعل. وقد تحقق ذلك من خلال استخدام مطياف الكتلة المقترن لفحص الغازات المنبعثة أثناء التفاعل.
ويؤدي الجمع بين هذه الأدوات - STA وفرن بخار الماء ومولد البخار ومطياف الكتلة المقترن - إلى إنشاء إعداد مثالي لتوصيف التفاعلات الجارية التي ينطوي عليها انقسام الماء الكيميائي الحراري بشكل شامل.