بوليميرز
راتنجات الإيبوكسي - المعالجة، التحكم في الانتشار الجزئي
يتم التحكم في سرعة التفاعل الكيميائي، الذي يساهم فيه أكثر من متفاعل واحد من خلال خطوتين:
1. سرعة انتشار المتفاعلات معًا (تتميز بـ Kdiff),
2. سرعة التفاعل الكيميائي (تتميز بـ Kchem).
سرعة التفاعل الفعالة هي قيمة المتوسط الهندسي لكلا ثابتي السرعة:
1/Keff = 1/Kdiff + 1/Kchem (معادلة رابينوفيتش).
من الواضح أن Keff يساوي Kchem، إذا كان Kdiff >> Kchem صحيحًا.
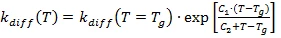
لذلك، في معظم الأحيان، لا يؤخذ تأثير التحكم في الانتشار في الاعتبار. إذا كانت درجة حرارة التفاعل قريبة من درجة حرارة الانتقال الزجاجي أو أصغر منها، عندئذٍ تلاحظ زيادة قوية في اللزوجة: تتزجج المادة قيد البحث. من خلال الحركة المحدودة للمواد المتفاعلة، يتم التحكم في عملية المعالجة بالانتشار ويكون Kchem >> Kdiff صحيحًا.
يتم إجراء جميع الحسابات والنمذجة والملاءمة والتنبؤات لهذا التطبيق في برنامج NETZSCH Kinetics Neo.
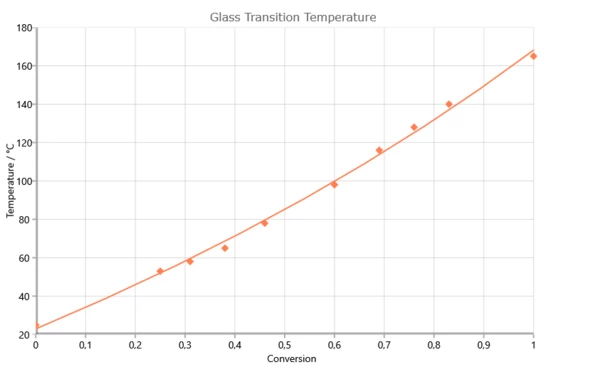
اعتماد درجة حرارة الانتقال الزجاجي على درجة التفاعل للنظام 2،2 س،6،6 س- رباعي البروم-بيسفينول-أ-ديجليسيد الأثير (RUETAPOX VE 3579) + 5% زنك (OCN)2 [Flammersheim, Opfermann: Thermochim. Acta 337(1999)141]
يتم حساب الاعتماد على درجة حرارة Kchem بواسطة معادلة أرهينيوس. نظرًا لأن Kdiff يتناسب عكسيًا مع اللزوجة، يتم استخدام اعتماده على درجة الحرارة. إذا كان أساس التحليل هو قياسات DSC، يتم استخدام درجة حرارة الانتقال الزجاجي واعتمادها على درجة التفاعل كقيمة متحكمة في اللزوجة. ووفقًا لاقتراح خاص، قدمه Wise [C.W.W.Wise, W.D.Cook, A.A.Goodwin: Polymer 38 (1997) 3251]، يتم حساب سرعة الانتشار عن طريق معادلة Williams-Landel-Ferry (WLF) المعدلة
بالنسبة لدرجات الحرارة T أقل من Tg، يتم تحويل معادلة WLF إلى معادلة أرهينيوس في ظل الشرطين أن يكون كل من الانتقال والاشتقاق الأول مستمرًا. طاقة التنشيط الحالية لـ T <Tg هي
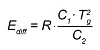
وبخلاف ذلك، إذا كان (ب) أساس التحليل هو قياسات اللزوجة، يتم استخدام اللزوجة المحسوبة كقيمة ضابطة. الآن يتم حساب اللزوجة عن طريق معادلة أرهينيوس مع طاقات تنشيط مختلفة للمادة غير المعالجة والمعالجة.
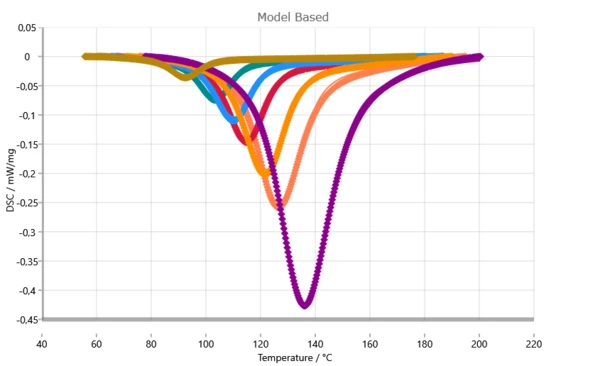
مقارنة بين منحنيات DSC المقاسة (الرموز) والمحسوبة (الخطوط الصلبة).
مع الأخذ في الاعتبار التحكم في الانتشار في التحليل الحركي، يتم تحقيق تطابق شبه مثالي. هذه الجودة العالية للمطابقة هي الشرط الأساسي للتنبؤات بمستوى عالٍ من الثقة.
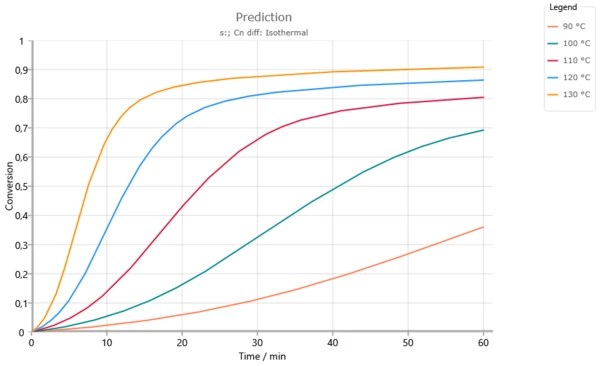
تنبؤات متساوية الحرارة لدرجات حرارة أقل من درجة حرارة الانتقال الزجاجي Tg = 165 درجة مئوية. زيادة درجة التواء التفاعل حيث تصل درجة حرارة الانتقال الزجاجي إلى درجة حرارة التفاعل (انظر الصورة التالية). وبدون استخدام التحكم في الانتشار فوق 120 درجة مئوية يتحقق التحويل الكامل بالفعل بعد 60 دقيقة.
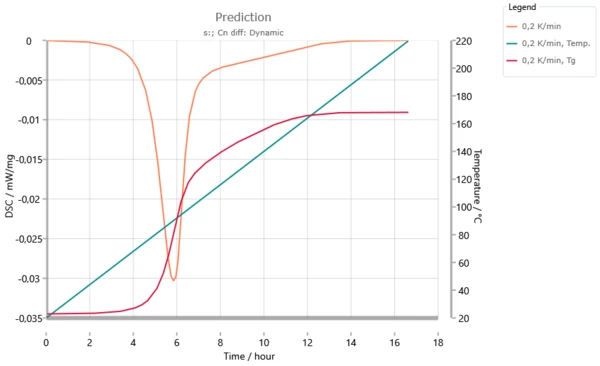
تصبح هذه المعلومات مفهومة من خلال الصورة التالية، وهي محاكاة لمعدل التسخين 0.2 كلفن/دقيقة: تصل درجة حرارة الانتقال الزجاجي إلى درجة حرارة التفاعل بعد 6 ساعات. من هنا وحتى وقت تفاعل يصل إلى 12 ساعة، يتفاعل الكثير من التفاعل بحيث تكون الزيادة في درجة حرارة الانتقال الزجاجي مساوية للزيادة في درجة حرارة التفاعل. في هذا النطاق يكون التفاعل محكومًا بالانتشار.
التنبؤ الديناميكي لمعدل تسخين 0.2 كلفن/دقيقة. تصل درجة حرارة الانتقال الزجاجي إلى درجة حرارة التفاعل بعد 6 ساعات. تنهار إشارة DSC باستثناء قيمة ثابتة. فوق 12 ساعة تزيد درجة حرارة الانتقال الزجاجي Tg عن درجة حرارة التفاعل. يتوقف النظام عن حالة "التزجيج".