ПОЛИМЕРЫ
Эпоксидная смола - отверждение, контроль частичной диффузии
Скорость химической реакции, в которой участвует более одного реактива, контролируется двумя этапами:
1. скорость совместной диффузии реактантов (характеризуется Kdiff),
2. скорость химической реакции (характеризуется Kchem).
Эффективная скорость реакции - это среднее геометрическое значение обеих констант скорости:
1/Keff= 1/Kdiff + 1/Kchem (уравнение Рабиновича).
Очевидно, что Keff равна Kchem, если Kdiff >> Kchem.
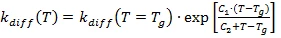
Поэтому в большинстве случаев эффект диффузионного контроля не учитывается. Если температура реакции близка к температуре стеклования или smallвыше ее, то наблюдается сильное увеличение вязкости: исследуемый материал стеклообразен. Благодаря ограниченной подвижности реактантов, процесс отверждения контролируется диффузией, и Kchem >> Kdiff является истинным.
Все расчеты, моделирование, подгонка и прогнозы для данного приложения выполнены в программе NETZSCH Kinetics Neo.
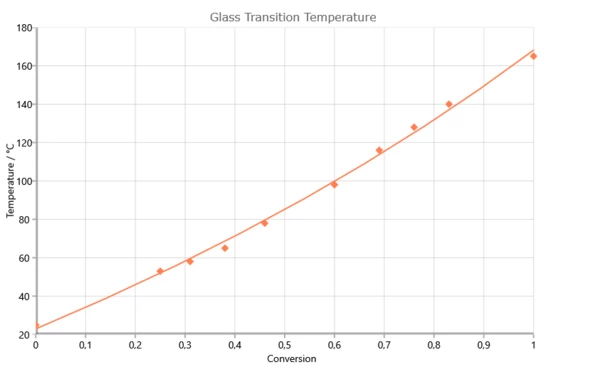
Зависимость температуры стеклования от степени реакции для системы 2,2¥,6,6¥-тетрабром-бисфенол-А-диглицидилэфир (RUETAPOX VE 3579) + 5% Zn(OCN)2 [Flammersheim, Opfermann: Thermochim. Acta 337(1999)141]
Температурная зависимость Kchem рассчитывается по уравнению Аррениуса. Поскольку Kdiff обратно пропорционален вязкости, используется его зависимость от температуры. Если (а) основой анализа являются измерения ДСК, то в качестве контрольного значения вязкости используется температура стеклования и ее зависимость от степени реакции. Согласно специальному предложению, сделанному Уайзом [C.W.Wise, W.D.Cook, A.A.Goodwin: Polymer 38 (1997) 3251], скорость диффузии рассчитывается с помощью модифицированного уравнения Уильямса-Ланделя-Ферри (WLF)
Для температур T ниже Tg уравнение WLF преобразуется в уравнение Аррениуса при условии, что как перенос, так и 1-е производное являются непрерывными. Текущая энергия активации для T<Tg составляет:
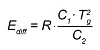
В противном случае, если (b) основой анализа являются измерения вязкости, то в качестве контрольного значения используется расчетная вязкость. Теперь вязкость рассчитывается с помощью уравнения Аррениуса с различными энергиями активации для неотвержденного и отвержденного материала.
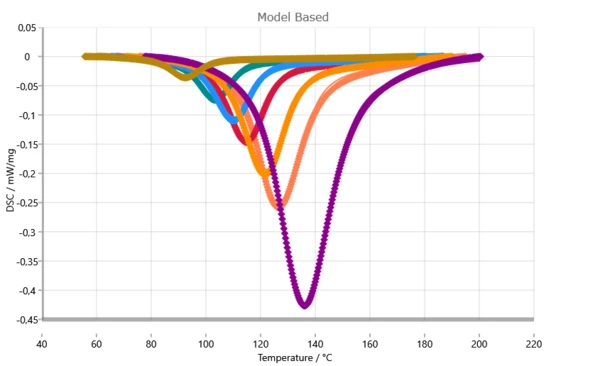
Сравнение измеренных (символы) и рассчитанных (сплошные линии) кривых ДСК.
Учитывая диффузионный контроль в кинетическом анализе, достигается практически идеальное соответствие. Такое высокое качество подгонки является основным условием для прогнозов с высоким уровнем достоверности.
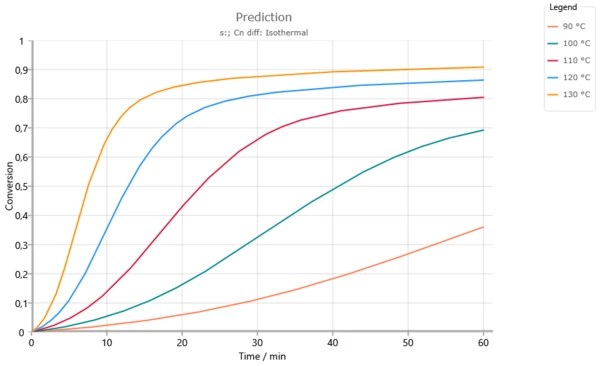
Изотермические прогнозы для температур ниже температуры стеклования Tg = 165°C. Увеличение степени перегиба реакции происходит там, где температура стеклования достигает температуры реакции (см. следующий рисунок). Без использования диффузионного контроля при температуре выше 120°C полная конверсия была бы достигнута уже через 60 минут.
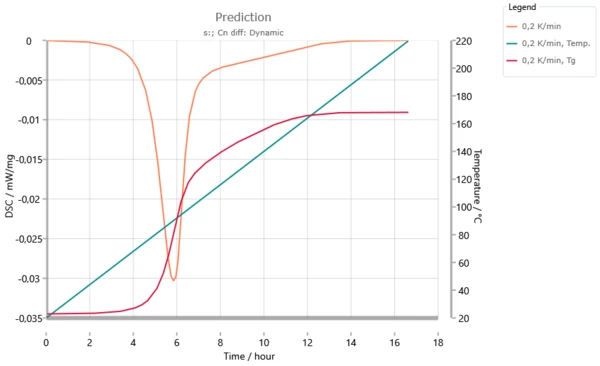
Эта информация становится понятной с помощью следующего рисунка, моделирующего скорость нагрева 0,2 К/мин: температура стеклования достигает температуры реакции через 6 часов. Начиная с этого момента и до времени реакции 12 часов, в реакцию вступает столько вещества, что повышение температуры стеклования равно повышению температуры реакции. В этом диапазоне реакция контролируется диффузией.
Динамический прогноз для скорости нагрева 0,2 К/мин. Температура стеклования достигает температуры реакции через 6 часов. Сигнал ДСК исчезает, за исключением постоянного значения. Через 12 часов температура стеклования Tg увеличивается меньше, чем температура реакции. Система перестает находиться в состоянии "стеклования".