POLIMERI
Resina epossidica - Polimerizzazione, controllo della diffusione parziale
La velocità di una reazione chimica, a cui contribuiscono più di un reagente, è controllata da due fasi:
1. la velocità di diffusione dei reagenti tra loro (caratterizzata da Kdiff),
2. la velocità di reazione chimica (caratterizzata da Kchem).
La velocità di reazione effettiva è il valore medio geometrico di entrambe le costanti di velocità:
1/Keff = 1/Kdiff + 1/Kchem (equazione di Rabinowitch).
È ovvio che Keff è uguale a Kchem, se è vero che Kdiff >> Kchem.
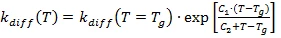
Pertanto, per la maggior parte, l'effetto del controllo della diffusione non viene preso in considerazione. Se la temperatura di reazione è vicina o smallsuperiore alla temperatura di transizione vetrosa, si osserva un forte aumento della viscosità: il materiale in esame vetrifica. Grazie alla mobilità limitata dei reagenti, il processo diPolimerizzazione (reazioni di reticolazione)Tradotto letteralmente, il termine "crosslinking" significa "reticolo incrociato". Nel contesto chimico, viene utilizzato per le reazioni in cui le molecole vengono collegate tra loro introducendo legami covalenti e formando reti tridimensionali. polimerizzazione è controllato dalla diffusione ed è vero che Kchem >> Kdiff.
Tutti i calcoli, la modellazione, l'adattamento e le previsioni per questa applicazione sono stati eseguiti nel software NETZSCH Kinetics Neo.
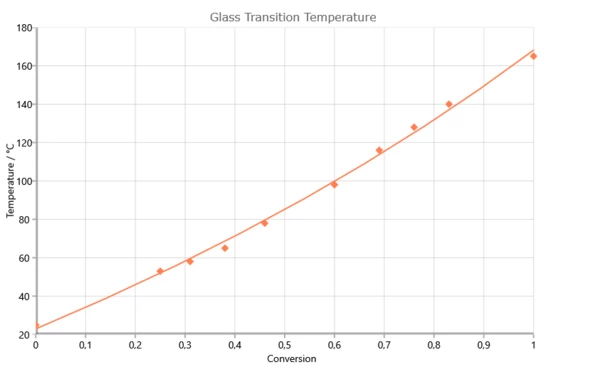
Dipendenza della temperatura di transizione vetrosa dal grado di reazione per il sistema 2,2¥,6,6¥-tetrabrom-bisfenolo-A-diglicidiletere (RUETAPOX VE 3579) + 5% Zn(OCN)2 [Flammersheim, Opfermann: Thermochim. Acta 337(1999)141]
La dipendenza dalla temperatura di Kchem viene calcolata con l'equazione di Arrhenius. Poiché Kdiff è inversamente proporzionale alla viscosità, viene utilizzata la sua dipendenza dalla temperatura. Se (a) la base di analisi sono le misure DSC, allora la temperatura di transizione vetrosa e la sua dipendenza dal grado di reazione viene utilizzata come valore di controllo della viscosità. Secondo una proposta speciale, avanzata da Wise [C.W.Wise, W.D.Cook, A.A.Goodwin: Polymer 38 (1997) 3251], la velocità di diffusione viene calcolata mediante un'equazione Williams-Landel-Ferry (WLF) modificata
Per temperature T inferiori a Tg, l'equazione WLF viene trasformata in un'equazione di Arrhenius a condizione che sia il trasferimento che la prima derivazione siano continui. L'energia di attivazione attuale per T<Tg è:
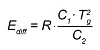
Altrimenti, se (b) la base di analisi sono le misurazioni della viscosità, allora la viscosità calcolata viene utilizzata come valore di controllo. A questo punto, la viscosità viene calcolata mediante un'equazione di Arrhenius con diverse energie di attivazione per il materiale non polimerizzato e per quello polimerizzato.
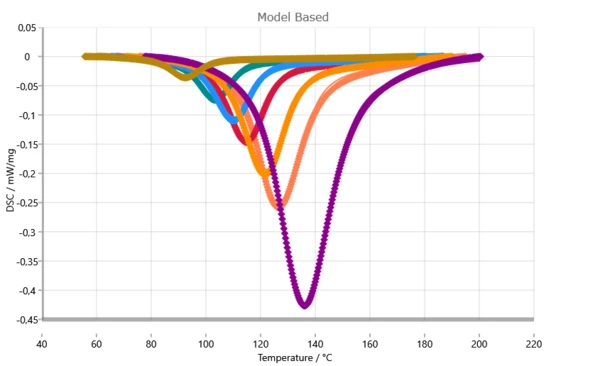
Confronto tra le curve DSC misurate (simboli) e calcolate (linee solide).
Tenendo conto del controllo della diffusione nell'analisi cinetica, si ottiene un adattamento quasi perfetto. Questa elevata qualità di adattamento è la condizione di base per previsioni con un elevato livello di confidenza.
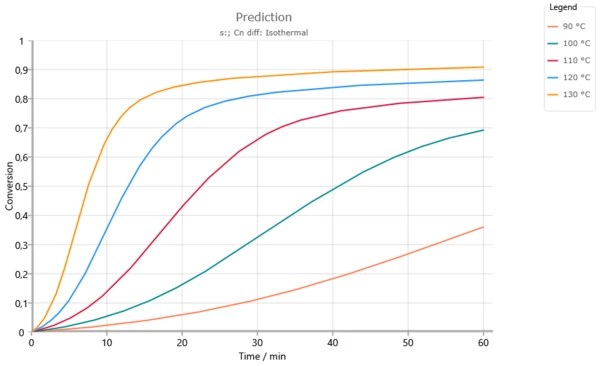
Previsioni isoterme per temperature inferiori alla temperatura di transizione vetrosa Tg = 165°C. L'aumento del grado di reazione si verifica quando la temperatura di transizione vetrosa raggiunge la temperatura di reazione (vedi figura seguente). Senza l'uso del controllo della diffusione, al di sopra dei 120°C la conversione completa sarebbe già raggiunta dopo 60 minuti.
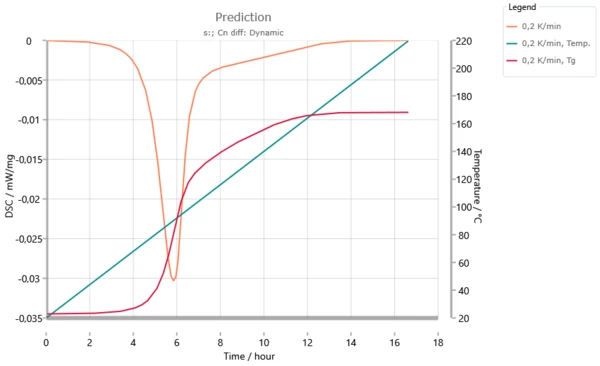
Questa informazione diventa comprensibile attraverso la figura seguente, una simulazione per la velocità di riscaldamento di 0,2 K/min: la temperatura di transizione vetrosa raggiunge la temperatura di reazione dopo 6 ore. Da qui fino a un tempo di reazione di 12 ore, la reazione è tale che l'aumento della temperatura di transizione vetrosa è pari all'aumento della temperatura di reazione. In questo intervallo la reazione è controllata dalla diffusione.
Previsione dinamica per una velocità di riscaldamento di 0,2 K/min. La temperatura di transizione vetrosa raggiunge la temperatura di reazione dopo 6 ore. Il segnale DSC si interrompe ad eccezione di un valore costante. Oltre le 12 ore la temperatura di transizione vetrosa Tg aumenta meno della temperatura di reazione. Il sistema interrompe la condizione di "vetrificazione".