27.03.2023 by Dr. Ligia de Souza
DSC لتحديد الذوبان المثالي؟ أخبرني كيف!
يعد قياس المسعر بالمسح التفاضلي (DSC) تقنية تحليلية مستخدمة على نطاق واسع في صناعة المستحضرات الصيدلانية لفحص الخواص الحرارية للمواد الدوائية. ويتمثل أحد التطبيقات الرئيسية لتقنية DSC في تحديد قابلية الذوبان المثالية للدواء، وهو أمر بالغ الأهمية لتطوير تركيبات صيدلانية فعالة وآمنة. في هذه المقالة، سوف نستكشف كيف يمكن استخدام DSC لتحديد الذوبان المثالي للأدوية، والعوامل التي يمكن أن تؤثر على سلوك الذوبان. وسواء كنت باحثًا أو عالمًا أو مُركِّبًا في صناعة المستحضرات الصيدلانية، ستزودك هذه المقالة برؤى قيمة حول استخدام أداة DSC من NETZSCH للتحليل والاختبار لتحديد الذوبان المثالي. لذا، دعونا نتعمق في هذا الموضوع!
تصنيف الأدوية بناءً على قابلية الذوبان
الذوبان المائي ضروري لوصول الدواء إلى هدفه العلاجي، نظرًا لأن معدل الذوبان يؤثر بشكل مباشر على التوافر البيولوجي للدواء. يصنّف دستور الأدوية الأمريكي ودستور الأدوية الأوروبي الأدوية بناءً على نطاق الذوبان التقريبي بالمليجرام/مل. على سبيل المثال، 100-1000 مجم/مل هو نطاق الذوبان للجزيء الذي يعتبر قابل للذوبان الحر، و0.1-1 مجم/مل هو نطاق جزيء دواء يتميز بقابلية ذوبان طفيفة جدًا في الماء. ولذلك، فإن تحديد قابلية الذوبان المائي وغير المائي سيحدد أفضل نهج تركيب ممكن لعقار مرشح جيد.
تعطي الذوبانية المثالية التركيز المشبع للمذاب، بالجزء المولي، عند استخدام مذيب مثالي، أي الحالة النظرية لذوبان المذاب في مذيب دون أي فقدان للطاقة أثناء عملية الذوبان. في الممارسة العملية، لا يمكن تحقيق ذلك لأن التفاعل بين المذاب والمذيب عادةً ما يكون غير مثالي وقد يعيق التفاعل الكيميائي بين المذاب والمذيب عملية الذوبان. ومن الأمثلة على هذه التفاعلات بين الجزيئات الروابط الهيدروجينية والخواص العازلة وعزم ثنائي القطب.
في حين أن الطريقة المفضلة لتحديد ذوبانية الجزيء هي القياس الطيفي بالأشعة فوق البنفسجية، يمكن حساب الذوبانية المثالية إذا كانت درجة انصهار المادة وإنثالبي الانصهار معروفة.
ومع ذلك، ماذا تعني الذوبانية المثالية من الناحية الديناميكية الحرارية؟
في عملية الذوبان، يجب كسر الروابط بين المذاب والمذاب. ومدخلات الطاقة اللازمة لكسر هذه الروابط تساوي الطاقة اللازمة لصهر المادة الصلبة؛ أي إنثالبي الانصهار(∆Hf). من ناحية أخرى، يجب أيضًا كسر الروابط بين المذيب والمذيب بينما يجب تكوين روابط المذيب والمذيب. ويمكن تسمية مدخلات الطاقة لهذه الخطوة الأخيرة بإنثالبي الخلط(∆Hmix). وبالتالي، فإن إنثالبي الذوبان هو مجموع إنثالبي الاندماج وإنثالبي الخلط:
∆Hsol = ∆Hf + ∆Hmix
إذا كان إنثالبي الخلط يساوي صفرًا، فإن إنثالبي الذوبان يساوي إنثالبي الاندماج:
∆Hsol = ∆Hf
هذه هي الافتراضات الديناميكية الحرارية الرئيسية للذوبان المثالي للمادة البلورية. يؤدي الذوبان المثالي إلى ذوبان مثالي.
الافتراضات الأخرى هي أن ∆Hf موجب (الاندماج حدث ماص للحرارة) وكذلك ∆Hsol. ومع ذلك، لكي يحدث التفاعل التلقائي، يجب أن تكون طاقة جيبس الحرة(∆G = ∆Hf -T∆S)سالبة؛ وبالتالي، يجب أن تكون الإنتروبي(S) موجبة. مع الأخذ في الاعتبار أن درجة حرارة الانصهار وإنثالبي الانصهار مستقلان عن درجة الحرارة التجريبية، وأن الذوبان سيوفر محلولاً مشبعًا، يمكن تطبيق معادلة فان هتوف على النحو التالي:
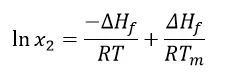
حيث: x2 = التركيز المشبع للدواء بوحدات الكسر المولي
∆Hf = إنثالبي الانصهار (جول/مول)
r = ثابت الغاز (جول/كيلو مول)
ت = درجة الحرارة المعطاة (كلفن)
tm = درجة حرارة الانصهار (كلفن)
ينتج عن النتيجة التركيز المشبع للمذاب في المذيب المثالي، بالجزء المولي. بعبارة أخرى، سيكون هذا أقصى تركيز يمكن تحقيقه للدواء في أفضل مذيب ممكن. يستشهد كتاب الصيدلانيات لألتون [1] بمثال حمض أسيتيل الساليسيليك. تبلغ قابلية الذوبان المثالية (المحسوبة) لحمض أسيتيل الساليسيليك 0.037 جزء مول؛ وأفضل مذيب مدرج هو رباعي هيدرو الفوران (THF)، الذي تبلغ قابلية ذوبانه المحددة تجريبيًا 0.036 جزء مول. وبالتالي فإن THF قريب من كونه المذيب المثالي لحمض أسيتيل الساليسيليك. ومع ذلك، من المهم أن نأخذ في الاعتبار أن التفاعلات بين الجزيئات قد تساعد أيضًا على الذوبان، مما يوفر قابلية ذوبان تجريبية أعلى من تلك المقدرة بواسطة معادلة فانت هوف.
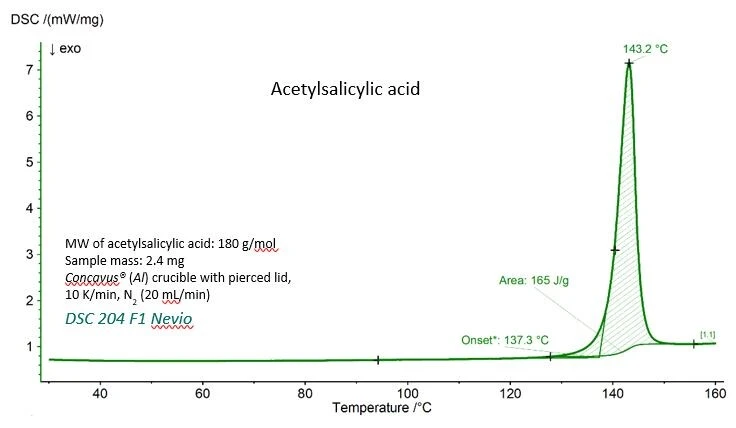
يوضح الشكل 1 منحنى DSC لحمض أسيتيل الساليسيليك مع القيم التجريبية لدرجة حرارة الانصهار (درجة حرارة البداية المستنبطة) وإنثالبي الاندماج (المساحة تحت القمة). تتفق كلتا القيمتين بشكل جيد للغاية مع القيم المرجعية التي قدمها المعهد الوطني للمعايير والتكنولوجيا (NIST)، كما يتضح من الجدول 1.
الجدول 1 - القيم التجريبية والمرجعية لدرجة حرارة الانصهار ودرجة حرارة الانصهار لحمض أسيتيل الساليسيليك.
المعلمة | تجريبي | المرجع (كتاب ويب الكيمياء التابع للمعهد الوطني للمعايير الدولية للمعايير والتكنولوجيا) |
| درجة حرارة الانصهار (البداية الاستقرائية) | 410.4 كلفن (137.3 درجة مئوية) | 405±10 K |
إنثالبي الاندماج (المساحة تحت القمة) | 29.7 كيلوجول/مول (165 جول/ز) | 29.17 - 31.01 كيلوجول/مول |
الأسبرين (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
يجب توخي الحذر، إذا كانت المادة التي تم تحليلها قد تتعرض للتدهور الحراري أثناء قياس DSC. في حالة مثال حمض أسيتيل الساليسيليك الموضح هنا، تم تسجيل فقدان كتلة بنسبة 1.01% تم تحديدها باستخدام جهاز NETZSCH TGA، الشكل 2. هذه القيمة مقبولة حيث تنص ASTM 928 على 1% كحد أقصى للكتلة في نطاق الذوبان. إذا لم يكن TGA متاحًا، فإن وزن البوتقة والعينة قبل القياس وبعده هو أفضل طريقة لمراقبة فقدان الكتلة.
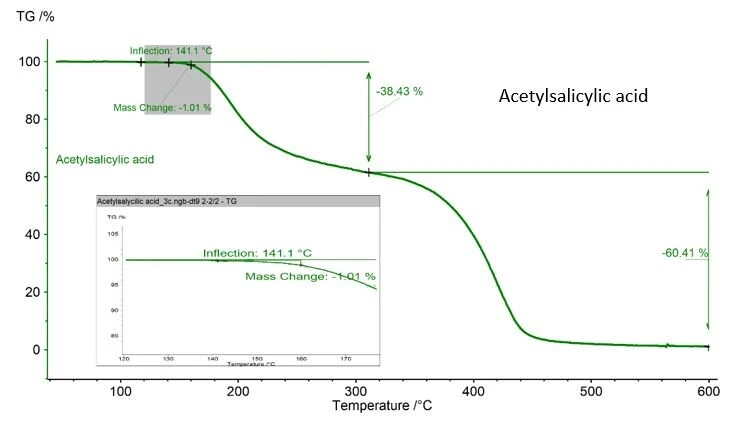
تُعد التحولات الطورية، والتفاعل بين المواد الصلبة والصلبة، والتغيرات في التركيب الكيميائي، وتحديد النقاء أمثلة على تطبيقات DSC - وهي تقنية حساسة توفر نتائج دقيقة ومحددة.
مرجع:
[1] صيدلانيات أولتون، الإصدارالسادس، ISBN: 9780702081545
الأسبرين (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
ملخص
في الختام، يمكن أن يساهم استخدام الأدوات من NETZSCH للتحليل والاختبار بشكل كبير في تحديد الذوبان المثالي للأدوية في عملية تطوير المستحضرات الصيدلانية. ومن خلال توفير رؤى قيمة حول الخصائص الحرارية للمواد الدوائية، يمكن أن يساعد DSC وTGA واضعي التركيبات الدوائية والعلماء على تحسين تركيبات الأدوية لتحسين التوافر البيولوجي والفعالية.
إذا كنت مهتمًا بمعرفة المزيد عن كيفية دعم NETZSCH للتحليل والاختبار لاحتياجاتك في تطوير المستحضرات الصيدلانية، تفضل بزيارة موقعنا الإلكتروني لمزيد من المعلومات. خبراؤنا هنا لمساعدتك في كل خطوة على الطريق.
هل تعرف بالفعل كتابنا التطبيقي "التحليل الحراري في المجال الصيدلاني"؟
ويستخدم هذا الكتاب التطبيقي مجموعة متنوعة من الأمثلة التطبيقية المحددة لتوضيح كيفية إجراء التجارب المقابلة والاستنتاجات التي يمكن استخلاصها من النتائج.

يحتوي الكتاب على ثمانية فصول في أكثر من 260 صفحة حول:
- طرق التحليل الحراري (DSC وTGA وSTA وتحليل الغازات)
- توصيف المراحل غير المتبلورة والبلورية
- النقاء
- الاستقرار الحراري
- الثبات التأكسدي
- ظروف التخزين ومدة الصلاحية
- تعدد الأشكال والتوافق