27.03.2023 by Dr. Ligia de Souza
ДСК для определения идеальной растворимости? Расскажите мне, как!
Дифференциальная сканирующая калориметрия (ДСК) - широко используемый в фармацевтической промышленности аналитический метод для исследования термических свойств лекарственных веществ. Одним из ключевых применений ДСК является определение идеальной растворимости лекарственного средства, что имеет решающее значение для разработки эффективных и безопасных фармацевтических рецептур. В этой статье мы рассмотрим, как ДСК может быть использована для определения идеальной растворимости лекарств, а также факторы, которые могут повлиять на поведение растворимости. Независимо от того, являетесь ли вы специалистом по исследованиюarc, ученым или разработчиком рецептур в фармацевтической промышленности, эта статья предоставит вам ценные сведения об использовании прибора ДСК от NETZSCH Analyzing & Testing для определения идеальной растворимости. Итак, давайте погрузимся в эту тему!
Классификация лекарств по растворимости
Водная растворимость необходима для того, чтобы лекарство достигло терапевтической цели, поскольку скорость растворения напрямую влияет на биодоступность препарата. Фармакопея США и Европейская фармакопея классифицируют лекарственные средства на основе их приблизительного диапазона растворимости в мг/мл. Например, 100-1000 мг/мл - это диапазон растворимости для молекулы, считающейся свободно растворимой, а 0,1-1 мг/мл - для молекулы препарата, характеризующейся очень слабой растворимостью в воде. Таким образом, определение водной и неводной растворимости определяет наилучший подход к разработке рецептуры для хорошего лекарственного кандидата.
Идеальная растворимость дает насыщенную концентрацию растворителя в мольных долях при использовании идеального растворителя, т.е. теоретический случай, когда растворитель растворяется в растворителе без каких-либо потерь энергии в процессе растворения. На практике это недостижимо, поскольку взаимодействие растворителя с растворителем обычно неидеально и химическое взаимодействие между растворителем и растворителем может препятствовать процессу растворения. Примерами таких межмолекулярных взаимодействий являются водородные связи, диэлектрические свойства и дипольный момент.
Хотя для определения растворимости молекулы используется метод УФ-спектрофотометрии, идеальная растворимость может быть рассчитана, если известны температура плавления и энтальпия плавления вещества.
Однако что означает идеальная растворимость с точки зрения термодинамики?
В процессе растворения необходимо разорвать связи между растворителем и твердым веществом. Энергия, необходимая для разрыва этих связей, равна энергии, необходимой для плавления твердого тела, т.е. энтальпии плавления(∆Hf). С другой стороны, связи растворитель-растворитель также должны быть разорваны, в то время как связи растворитель-растворитель должны быть образованы. Энергия, затрачиваемая на этот последний шаг, может быть названа энтальпией смешивания(∆Hmix). Таким образом, энтальпия растворения равна сумме энтальпии плавления и энтальпии смешивания:
∆Hsol = ∆Hf + ∆Hmix
Если энтальпия смешения равна нулю, то энтальпия растворения равна энтальпии плавления:
∆Hsol = ∆Hf
Это основные термодинамические предположения для идеального растворения кристаллического материала. Идеальное растворение приводит к идеальной растворимости.
Согласно другим предположениям, ∆Hf положительна (плавление - эндотермическое явление), как и ∆Hsol. Однако для того чтобы реакция протекала спонтанно, свободная энергия Гиббса(∆G = ∆Hf -T∆S)должна быть отрицательной; следовательно, энтропия(S) должна быть положительной. Учитывая, что температура плавления и энтальпия плавления не зависят от экспериментальной температуры и что при растворении образуется насыщенный раствор, уравнение Ван'т-Хоффа можно применить следующим образом:
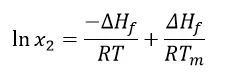
Где: x2 = насыщенная концентрация препарата в единицах мольных долей
∆Hf = энтальпия плавления (Дж/моль)
r = газовая постоянная (Дж/К∙моль)
t = заданная температура (K)
tm = температура плавления (K)
Результат дает насыщенную концентрацию растворителя в идеальном растворителе в мольных долях. Другими словами, это максимально достижимая концентрация препарата в наилучшем возможном растворителе. В книге Aulton's Pharmaceutics [1] приводится пример с ацетилсалициловой кислотой. Рассчитанная (идеальная) растворимость ацетилсалициловой кислоты составляет 0,037 мольных долей; лучшим растворителем является тетрагидрофуран (THF), экспериментально определенная растворимость которого составляет 0,036 мольных долей. Таким образом, THF близок к тому, чтобы стать идеальным растворителем для ацетилсалициловой кислоты. Однако важно учитывать, что межмолекулярные взаимодействия также могут способствовать растворению, обеспечивая экспериментальную растворимость выше, чем та, которая оценивается по уравнению Ван'т-Хоффа.
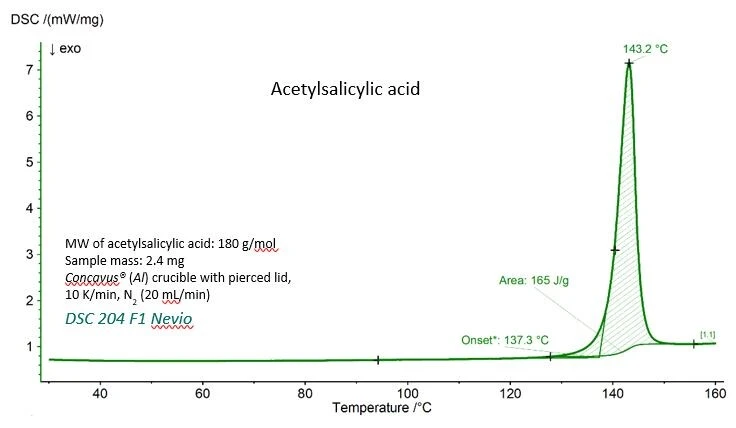
Кривая ДСК для ацетилсалициловой кислоты с экспериментальными значениями температуры плавления (экстраполированная температура начала плавления) и энтальпии плавления (площадь под пиком) показана на рисунке 1. Как видно из таблицы 1, оба значения хорошо согласуются с эталонными значениями, приведенными Национальным институтом стандартов и технологий (NIST).
Таблица 1 - Экспериментальные и справочные значения температуры плавления и энтальпии плавления для ацетилсалициловой кислоты.
Параметр | Экспериментальный | Эталонный (NIST Chemistry WebBook) |
| Температура плавления (экстраполированное начало) | 410.4 K (137,3 °C) | 405±10 K |
Энтальпия плавления (площадь под пиком) | 29.7 кДж/моль (165 Дж/г) | 29.17 - 31,01 кДж/моль |
Аспирин (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
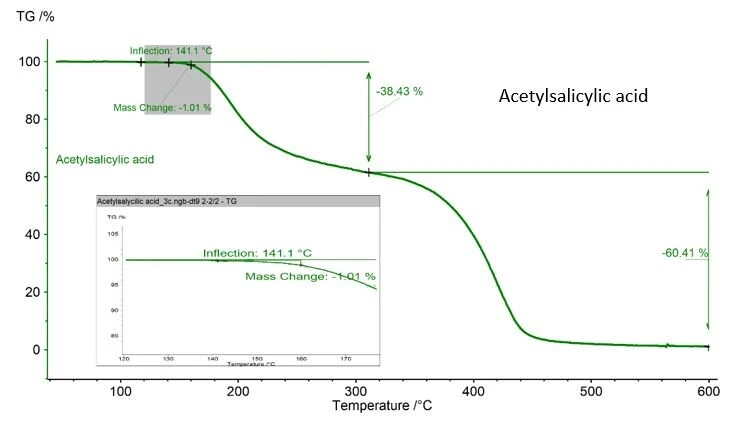
Необходимо соблюдать осторожность, если анализируемое вещество может подвергнуться термической деструкции во время измерения ДСК. В приведенном здесь примере с ацетилсалициловой кислотой зафиксирована потеря массы 1,01 %, определенная с помощью ТГА NETZSCH (рис. 2). Это значение является приемлемым, так как ASTM 928 устанавливает 1% как максимальную массу в диапазоне плавления. Если ТГА недоступен, лучшим способом контроля потери массы является взвешивание тигля и образца до и после измерения.
Фазовые переходы, взаимодействие твердого тела, изменения химического состава и purity determination - вот примеры применения ДСК - чувствительного метода, обеспечивающего точные и достоверные результаты.
Ссылки:
[1] Aulton's Pharmaceutics,6th edition, ISBN: 9780702081545
Аспирин (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
Резюме
В заключение следует отметить, что использование приборов от NETZSCH Analyzing & Testing может внести значительный вклад в определение идеальной растворимости лекарств в процессе фармацевтической разработки. Предоставляя ценные сведения о термических свойствах лекарственных веществ, ДСК и ТГА могут помочь разработчикам и ученым оптимизировать лекарственные формулы для повышения биодоступности и эффективности.
Если вы хотите узнать больше о том, как компания NETZSCH Analyzing & Testing может помочь вам в разработке фармацевтических препаратов, посетите наш сайт для получения дополнительной информации. Наши специалисты готовы помочь вам на каждом шагу.
Вы уже знакомы с нашей книгой-приложением "Термический анализ в фармацевтической отрасли"?
В этом учебнике по прикладным программам на конкретных примерах показано, как следует проводить соответствующие эксперименты и какие выводы можно сделать из полученных результатов.

Книга содержит восемь глав на более чем 260 страницах, посвященных:
- Методы термического анализа (ДСК, ТГА, СТА и газовый анализ)
- Характеристика аморфных и кристаллических фаз
- Чистота
- Термическая стабильность
- Окислительная стабильность
- Условия хранения и срок годности
- Полиморфизм и совместимость