27.03.2023 by Dr. Ligia de Souza
DSC per determinare la solubilità ideale? Dimmi come!
La calorimetria differenziale a scansione (DSC) è una tecnica analitica ampiamente utilizzata nell'industria farmaceutica per studiare le proprietà termiche delle sostanze farmacologiche. Una delle applicazioni principali della DSC è la determinazione della solubilità ideale di un farmaco, fondamentale per lo sviluppo di formulazioni farmaceutiche efficaci e sicure. In questo articolo analizzeremo come la DSC può essere utilizzata per determinare la solubilità ideale dei farmaci e i fattori che possono influenzare il comportamento della solubilità. Che siate ricercatoriarc, scienziati o formulatori dell'industria farmaceutica, questo articolo vi fornirà preziose indicazioni sull'uso dello strumento DSC di NETZSCH Analyzing & Testing per determinare la solubilità ideale. Quindi, tuffiamoci in questo argomento!
Classificazione dei farmaci in base alla solubilità
La solubilità acquosa è essenziale affinché un farmaco raggiunga il suo obiettivo terapeutico, dato che la velocità di dissoluzione influenza direttamente la biodisponibilità del farmaco. La Farmacopea degli Stati Uniti e la Farmacopea Europea classificano i farmaci in base al loro intervallo di solubilità approssimativo in mg/ml. Ad esempio, 100-1000 mg/ml è l'intervallo di solubilità per una molecola considerata liberamente solubile, mentre 0,1-1 mg/ml è l'intervallo per una molecola di farmaco caratterizzata da una solubilità in acqua molto lieve. Pertanto, la determinazione della solubilità acquosa e non acquosa definirà il miglior approccio formulativo possibile per un buon candidato farmaco.
La solubilità ideale fornisce la concentrazione satura di un soluto, in frazione molare, quando si utilizza un solvente ideale, cioè il caso teorico in cui un soluto viene disciolto in un solvente senza alcuna perdita di energia durante il processo di dissoluzione. In pratica, ciò non è realizzabile perché l'interazione soluto-solvente è solitamente non ideale e l'interazione chimica tra il soluto e il solvente può ostacolare il processo di dissoluzione. Esempi di queste interazioni intermolecolari sono i legami a idrogeno, le proprietà dielettriche e il momento di dipolo.
Sebbene il metodo di scelta per determinare la solubilità di una molecola sia la spettrofotometria UV, la solubilità ideale può essere calcolata se sono noti il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione e l'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione della sostanza.
Tuttavia, cosa significa solubilità ideale in termini termodinamici?
Nel processo di dissoluzione, i legami soluto-soluto devono essere spezzati. L'energia richiesta per rompere questi legami è pari all'energia necessaria per fondere un solido, cioè l'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione(∆Hf). D'altra parte, anche i legami solvente-solvente devono essere rotti, mentre i legami soluto-solvente devono essere formati. L'energia immessa per quest'ultima fase può essere chiamata entalpia di miscelazione(∆Hmix). Pertanto, l'entalpia di dissoluzione è la somma dell'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e dell'entalpia di miscelazione:
∆Hsol = ∆Hf + ∆Hmix
Se l'entalpia di miscelazione è uguale a zero, l'entalpia di dissoluzione è uguale all'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione:
∆Hsol = ∆Hf
Queste sono le principali ipotesi termodinamiche per la dissoluzione ideale di un materiale cristallino. La dissoluzione ideale porta a una solubilità ideale.
Altri presupposti sono che ∆Hf sia positivo (laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione è un evento EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico) e che lo sia anche ∆Hsol. Tuttavia, affinché si verifichi una reazione spontanea, l'energia libera di Gibbs(∆G = ∆Hf -T∆S)deve essere negativa; di conseguenza, l'entropia(S) deve essere positiva. Considerando che laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione e l'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione sono indipendenti dalla temperatura sperimentale e che la dissoluzione fornirà una soluzione satura, l'equazione di Van't Hoff può essere applicata come segue:
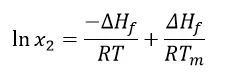
Dove: x2 = concentrazione satura del farmaco in unità di frazione molare
r = costante dei gas (J/K∙mol)
t = temperatura data (K)
Il risultato fornisce la concentrazione satura di un soluto nel solvente ideale, in frazione molare. In altre parole, si tratta della massima concentrazione ottenibile del farmaco nel miglior solvente possibile. Il libro Pharmaceutica di Aulton [1] cita l'esempio dell'acido acetilsalicilico. La solubilità ideale (calcolata) dell'acido acetilsalicilico è di 0,037 moli di frazione; il miglior solvente indicato è il tetraidrofurano (THF), la cui solubilità determinata sperimentalmente è di 0,036 moli di frazione. Il THF è quindi prossimo a essere il solvente ideale per l'acido acetilsalicilico. Tuttavia, è importante tenere presente che anche le interazioni intermolecolari possono favorire la dissoluzione, fornendo una solubilità sperimentale superiore a quella stimata dall'equazione di Van't Hoff.
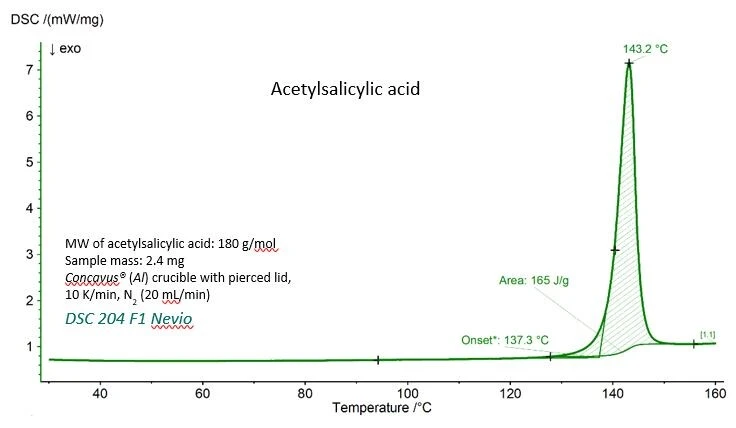
La curva DSC per l'acido acetilsalicilico con i valori sperimentali per laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione (temperatura di insorgenza estrapolata) e l'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione (area sotto il picco) sono mostrati nella figura 1. Entrambi i valori concordano molto bene con i valori di riferimento forniti dal National Institute Standards Technology (NIST), come si può vedere nella tabella 1. Entrambi i valori concordano molto bene con i valori di riferimento forniti dal National Institute of Standards and Technology (NIST), come si può notare nella tabella 1.
Tabella 1 - Valori sperimentali e di riferimento per laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione e l'entalpia diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'acido acetilsalicilico.
Parametro | Sperimentale | Riferimento (NIST Chemistry WebBook) |
| Temperatura di fusione (inizio estrapolato) | 410.4 K (137,3 °C) | 405±10 K |
Entalpia di fusione (area sotto il picco) | 29.7 kJ/mol (165 J/g) | 29.17 - 31,01 kJ/mol |
Aspirina (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
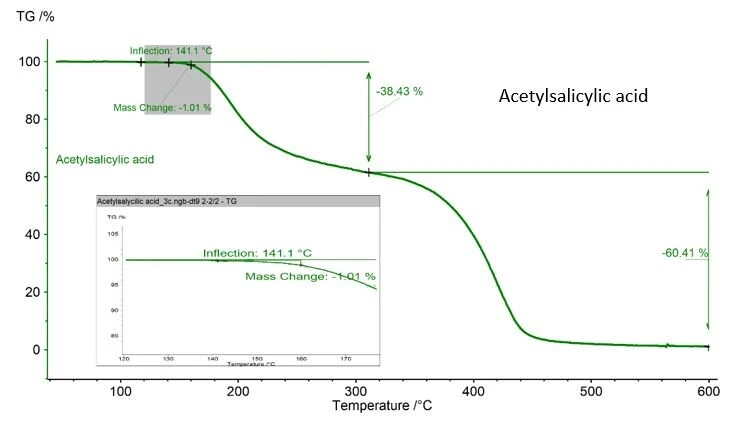
Occorre prestare attenzione se la sostanza analizzata può subire una degradazione termica durante la misurazione DSC. Nel caso dell'esempio dell'acido acetilsalicilico qui riportato, si registra una perdita di massa dell'1,01%, determinata con una TGA NETZSCH, figura 2. Questo valore è accettabile in quanto l'ASTM 9.0 è stata modificata per garantire che la sostanza non subisca una degradazione termica. Questo valore è accettabile in quanto l'ASTM 928 stabilisce l'1% come massa massima nell'intervallo di fusione. Se la TGA non è disponibile, il modo migliore per monitorare la perdita di massa è pesare il crogiolo e il campione prima e dopo la misurazione.
Le Transizioni di faseIl termine transizione di fase (o cambiamento di fase) è più comunemente usato per descrivere le transizioni tra gli stati solido, liquido e gassoso.transizioni di fase, l'interazione solido-solido, i cambiamenti nella composizione chimica e purity determination sono esempi di applicazioni del DSC, una tecnica sensibile che fornisce risultati accurati e precisi.
Riferimento:
[1] Farmaceutica di Aulton,6a edizione, ISBN: 9780702081545
Aspirina (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
Sintesi
In conclusione, l'uso degli strumenti di NETZSCH Analyzing & Testing può contribuire in modo significativo a determinare la solubilità ideale dei farmaci nel processo di sviluppo farmaceutico. Fornendo preziose informazioni sulle proprietà termiche dei farmaci, DSC e TGA possono aiutare formulatori e scienziati a ottimizzare le formulazioni dei farmaci per migliorarne la biodisponibilità e l'efficacia.
Se siete interessati a saperne di più su come NETZSCH Analyzing & Testing può supportare le vostre esigenze di sviluppo farmaceutico, visitate il nostro sito web per maggiori informazioni. I nostri esperti sono a disposizione per assistervi in ogni fase del processo.
Conoscete già il nostro libro applicativo "Analisi termica in campo farmaceutico"?
Questo libro di applicazioni utilizza una serie di esempi applicativi specifici per illustrare come devono essere eseguiti gli esperimenti corrispondenti e quali conclusioni si possono trarre dai risultati.

Il libro contiene otto capitoli di oltre 260 pagine su:
- Metodi di analisi termica (DSC, TGA, STA e analisi dei gas)
- Caratterizzazione delle fasi amorfe e cristalline
- Purezza
- Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). Stabilità termica
- Stabilità ossidativa
- Condizioni di stoccaggio e durata di conservazione
- Polimorfismo e compatibilità