27.03.2023 by Dr. Ligia de Souza
DSC do określania idealnej rozpuszczalności? Powiedz mi jak!
Różnicowa kalorymetria skaningowa (DSC) jest szeroko stosowaną techniką analityczną w przemyśle farmaceutycznym do badania właściwości termicznych substancji leczniczych. Jednym z kluczowych zastosowań DSC jest określenie idealnej rozpuszczalności leku, co ma kluczowe znaczenie dla opracowania skutecznych i bezpiecznych preparatów farmaceutycznych. W tym artykule zbadamy, w jaki sposób można wykorzystać DSC do określenia idealnej rozpuszczalności leków oraz czynników, które mogą wpływać na zachowanie rozpuszczalności. Niezależnie od tego, czy jesteś badaczemarcher, naukowcem czy formulatorem w przemyśle farmaceutycznym, ten artykuł dostarczy Ci cennych informacji na temat wykorzystania urządzenia DSC przez NETZSCH Analyzing & Testing do określania idealnej rozpuszczalności. Zanurzmy się więc w ten temat!
Klasyfikacja leków na podstawie rozpuszczalności
Rozpuszczalność w wodzie jest niezbędna, aby lek osiągnął swój cel terapeutyczny, biorąc pod uwagę, że szybkość rozpuszczania bezpośrednio wpływa na biodostępność leku. Farmakopea Amerykańska i Farmakopea Europejska klasyfikują leki w oparciu o ich przybliżony zakres rozpuszczalności w mg/ml. Na przykład 100-1000 mg/ml to zakres rozpuszczalności dla cząsteczki uważanej za swobodnie rozpuszczalną, a 0,1-1 mg/ml to zakres dla cząsteczki leku charakteryzującej się bardzo słabą rozpuszczalnością w wodzie. W związku z tym, określenie rozpuszczalności w wodzie i niewodzie określi najlepsze możliwe podejście do formulacji dla dobrego kandydata na lek.
Idealna rozpuszczalność podaje nasycone stężenie substancji rozpuszczonej, w ułamku molowym, gdy stosowany jest idealny rozpuszczalnik, tj. teoretyczny przypadek rozpuszczania substancji rozpuszczonej w rozpuszczalniku bez utraty energii podczas procesu rozpuszczania. W praktyce nie jest to osiągalne, ponieważ interakcja rozpuszczalnik-rozpuszczalnik jest zwykle nieidealna, a interakcje chemiczne między substancją rozpuszczoną a rozpuszczalnikiem mogą utrudniać proces rozpuszczania. Przykładami takich interakcji międzycząsteczkowych są wiązania wodorowe, właściwości dielektryczne i moment dipolowy.
Podczas gdy wybraną metodą określania rozpuszczalności cząsteczki jest spektrofotometria UV, idealną rozpuszczalność można obliczyć, jeśli znana jest Temperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo).temperatura topnienia i entalpia topnienia substancji.
Co jednak oznacza idealna rozpuszczalność w ujęciu termodynamicznym?
W procesie rozpuszczania, wiązania solute-solute muszą zostać zerwane. Energia wymagana do zerwania tych wiązań jest równa energii potrzebnej do stopienia ciała stałego, tj. entalpii fuzji(∆Hf). Z drugiej strony, wiązania rozpuszczalnik-rozpuszczalnik również muszą zostać zerwane, podczas gdy wiązania rozpuszczalnik-rozpuszczalnik muszą zostać utworzone. Energia włożona w ten ostatni etap może być nazywana entalpią mieszania(∆Hmix). Zatem entalpia rozpuszczania jest sumą entalpii syntezy i entalpii mieszania:
∆Hsol = ∆Hf + ∆Hmix
Jeśli entalpia mieszania jest równa zero, to entalpia rozpuszczania jest równa entalpii syntezy:
∆Hsol = ∆Hf
Są to główne założenia termodynamiczne dla idealnego rozpuszczania materiału krystalicznego. Idealne rozpuszczanie prowadzi do idealnej rozpuszczalności.
Inne założenia są takie, że ∆Hf jest dodatnie (fuzja jest zdarzeniem endotermicznym), podobnie jak ∆Hsol. Jednakże, aby zaszła spontaniczna reakcja, energia swobodna Gibbsa(∆G = ∆Hf -T∆S)musi być ujemna; zatem entropia(S) musi być dodatnia. Biorąc pod uwagę, że Temperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo).temperatura topnienia i entalpia topnienia są niezależne od temperatury eksperymentalnej, a rozpuszczanie zapewni roztwór nasycony, równanie Van't Hoffa można zastosować w następujący sposób:
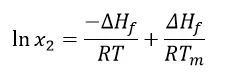
Gdzie: x2 = nasycone stężenie leku w jednostkach ułamka molowego
∆Hf = entalpia topnienia (J/mol)
r = stała gazowa (J/K∙mol)
t = dana temperatura (K)
Wynik daje nasycone stężenie substancji rozpuszczonej w idealnym rozpuszczalniku, w ułamku molowym. Innymi słowy, byłoby to maksymalne osiągalne stężenie leku w najlepszym możliwym rozpuszczalniku. Książka Aulton's Pharmaceutics [1] przytacza przykład kwasu acetylosalicylowego. (Obliczona) idealna rozpuszczalność kwasu acetylosalicylowego wynosi 0,037 ułamka molowego; najlepszym wymienionym rozpuszczalnikiem jest tetrahydrofuran (THF), którego doświadczalnie określona rozpuszczalność wynosi 0,036 ułamka molowego. THF jest zatem bliski bycia idealnym rozpuszczalnikiem dla kwasu acetylosalicylowego. Należy jednak pamiętać, że oddziaływania międzycząsteczkowe mogą również sprzyjać rozpuszczaniu, zapewniając eksperymentalną rozpuszczalność wyższą niż szacowana przez równanie Van't Hoffa.
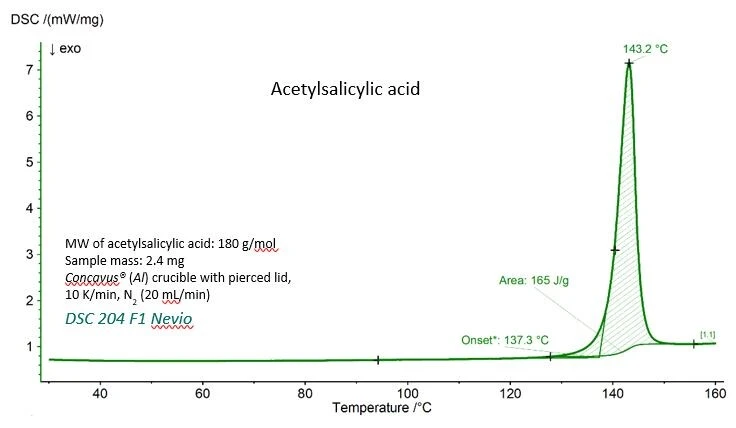
Krzywa DSC dla kwasu acetylosalicylowego z eksperymentalnymi wartościami temperatury topnienia (ekstrapolowana temperatura początku) i entalpii topnienia (powierzchnia pod pikiem) są pokazane na rysunku 1. Obie wartości zgadzają się bardzo dobrze z wartościami referencyjnymi podanymi przez National Institute of Standards and Technology (NIST), co można zobaczyć w tabeli 1.
Tabela 1 - Eksperymentalne i referencyjne wartości temperatury topnienia i entalpii topnienia dla kwasu acetylosalicylowego.
Parametr | Eksperymentalny | Referencyjny (NIST Chemistry WebBook) |
| Temperatura topnienia (ekstrapolowany początek) | 410.4 K (137,3 °C) | 405±10 K |
Entalpia syntezy (powierzchnia pod pikiem) | 29.7 kJ/mol (165 J/g) | 29.17 - 31,01 kJ/mol |
Aspiryna (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
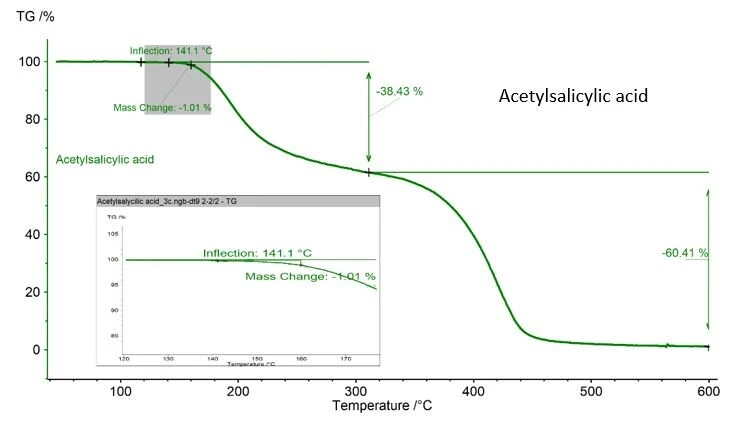
Należy zachować ostrożność, jeśli analizowana substancja może ulec degradacji termicznej podczas pomiaru DSC. W przypadku przedstawionego tutaj przykładu kwasu acetylosalicylowego odnotowano ubytek masy wynoszący 1,01%, określony za pomocą urządzenia NETZSCH TGA, rysunek 2. Wartość ta jest akceptowalna, ponieważ norma ASTM 928 określa 1% jako maksymalną masę w zakresie topnienia. Jeśli TGA nie jest dostępna, najlepszym sposobem monitorowania ubytku masy jest zważenie tygla i próbki przed i po pomiarze.
Przejścia fazoweTermin przejście fazowe (lub zmiana fazy) jest najczęściej używany do opisania przejść między stanem stałym, ciekłym i gazowym.Przejścia fazowe, interakcje ciało stałe-ciało stałe, zmiany składu chemicznego i purity determination to przykłady zastosowań DSC - czułej techniki, która zapewnia dokładne i precyzyjne wyniki.
Źródła:
[1] Aulton's Pharmaceutics, wydanie6, ISBN: 9780702081545
Aspiryna (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
Podsumowanie
Podsumowując, wykorzystanie urządzeń firmy NETZSCH Analyzing & Testing może znacząco przyczynić się do określenia idealnej rozpuszczalności leków w procesie rozwoju farmaceutycznego. Zapewniając cenny wgląd we właściwości termiczne substancji leczniczych, DSC i TGA mogą pomóc formulatorom i naukowcom zoptymalizować formuły leków w celu poprawy biodostępności i skuteczności.
Jeśli chcesz dowiedzieć się więcej o tym, jak NETZSCH Analyzing & Testing może wesprzeć Twoje potrzeby w zakresie rozwoju farmaceutycznego, odwiedź naszą stronę internetową, aby uzyskać więcej informacji. Nasi eksperci służą pomocą na każdym etapie.
Czy znasz już naszą książkę aplikacyjną "Analiza termiczna w branży farmaceutycznej"?
Ta książka aplikacji wykorzystuje szereg konkretnych przykładów zastosowań, aby zilustrować, w jaki sposób należy przeprowadzić odpowiednie eksperymenty i jakie wnioski można wyciągnąć z wyników.

Książka zawiera osiem rozdziałów na ponad 260 stronach na temat:
- Metod analizy termicznej (DSC, TGA, STA i analizy gazowej)
- Charakterystyka faz amorficznych i krystalicznych
- Czystość
- Stabilność termicznaMateriał jest stabilny termicznie, jeśli nie ulega rozkładowi pod wpływem temperatury. Jednym ze sposobów określenia stabilności termicznej substancji jest użycie analizatora termograwimetrycznego (TGA). Stabilność termiczna
- Stabilność oksydacyjna
- Warunki przechowywania i okres trwałości
- Polimorfizm i kompatybilność