27.03.2023 von Dr. Ligia de Souza
DSC zur Bestimmung der idealen Löslichkeit? So funktioniert´s!
Die dynamische Differenz-Kalorimetrie (engl. Differential Scanning Calorimetry, DSC) ist eine in der pharmazeutischen Industrie weit verbreitete Analysetechnik zur Untersuchung der thermischen Eigenschaften von Wirkstoffen. Eine der wichtigsten Anwendungen der DSC ist die Bestimmung der idealen Löslichkeit eines Arzneimittels, die für die Entwicklung wirksamer und sicherer pharmazeutischer Formulierungen entscheidend ist. Dieser Artikel befasst sich damit, wie die DSC zur Bestimmung der idealen Löslichkeit eingesetzt werden kann und welche Faktoren das Löslichkeitsverhalten beeinflussen können. Egal, ob Sie sich mit Forschung, Entwicklung oder Formulierung beschäftigen, dieser Artikel wird Ihnen wertvolle Einblicke in die Verwendung des DSC-Geräts von NETZSCH Analysieren & Prüfen zur Bestimmung der idealen Löslichkeit geben. Lassen Sie uns daher tiefer in dieses Thema eintauchen!
Klassifizierung von Arzneimitteln aufgrund ihrer Löslichkeit
Die Wasserlöslichkeit ist entscheidend dafür, dass ein Arzneimittel sein therapeutisches Ziel erreicht, da die Auflösungsgeschwindigkeit dessen Bioverfügbarkeit direkt beeinflusst. Die US-amerikanischen und europäischen Arzneibücher klassifizieren Pharmazeutika auf der Grundlage ihres ungefähren Löslichkeitsbereichs in mg/ml. Zum Beispiel ist 100 - 1000 mg/ml der Löslichkeitsbereich eines Moleküls, das als frei löslich gilt, und 0,1 - 1 mg/ml ist der Bereich eines sehr schwer wasserlöslichen Arzneimittelmoleküls. Durch die Bestimmung der wässrigen und nicht-wässrigen Löslichkeit wird daher der bestmögliche Formulierungsansatz für einen guten Arzneimittelkandidaten festgelegt.
Die ideale Löslichkeit gibt die gesättigte Konzentration eines gelösten Stoffes als Molfraktion an, wenn ein ideales Lösungsmittel verwendet wird, d. h. der theoretische Fall, dass ein gelöster Stoff in einem Lösungsmittel ohne Energieverlust während des Auflösungsprozesses gelöst wird. In der Praxis ist dies nicht möglich, da die Wechselwirkung zwischen dem gelösten Stoff und dem Lösungsmittel in der Regel nicht ideal ist und die chemische Wechselwirkung zwischen dem gelösten Stoff und dem Lösungsmittel den Auflösungsprozess behindern kann. Beispiele für solche intermolekularen Wechselwirkungen sind Wasserstoffbrücken, dielektrische Eigenschaften und das Dipolmoment.
Obwohl die Methode der Wahl zur Bestimmung der Löslichkeit eines Moleküls die UV-Photospektrometrie ist, kann die ideale Löslichkeit auch aus dem Schmelzpunkt und der Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelzenthalpie eines Stoffes berechnet werden.
Doch was bedeutet ideale Löslichkeit im thermodynamischen Sinn?
Beim Auflösungsprozess müssen die Bindungen im Feststoff aufgebrochen werden. Die dazu nötige Energie entspricht der Energie, die zum Schmelzen eines Festkörpers benötigt wird, d. h. der Schmelzenthalpie (∆Hf). Andererseits müssen auch Lösungsmittel-Lösungsmittel-Bindungen gebrochen und Bindungen zwischen Lösungsmittel und gelöstem Stoff gebildet werden Der Energieaufwand für diesen letzten Schritt kann als Mischungsenthalpie (∆Hmix) bezeichnet werden. Die Lösungsenthalpie ist also die Summe aus Schmelz- und Mischungsenthalpie:
∆Hsol = ∆Hf + ∆Hmix
Ist die Mischungsenthalpie gleich Null, dann ist die Lösungsenthalpie gleich der Schmelzenthalpie:
∆Hsol = ∆Hf
Dies sind die wichtigsten thermodynamischen Annahmen für die ideale Auflösung eines kristallinen Materials. Eine ideale Auflösung führt zu idealer Löslichkeit.
Weiterhin wird angenommen, dass ∆Hf - und somit auch ∆Hsol - positiv ist (Schmelzen ist ein endothermer Vorgang). Damit es jedoch zu einer spontanen Reaktion kommt, muss die Gibbs-freie Energie (∆G = ∆Hf -T∆S)negativ und die Entropie (S) somit positiv sein. Zieht man in Betracht, dass die Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelztemperatur und -enthalpie unabhängig von der Versuchstemperatur sind und dass die Auflösung eine gesättigte Lösung ergibt, kann die Van’t Hoff-Gleichung wie folgt angewandt werden:
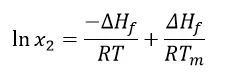
mit: x2 = gesättigte Konzentration des Arzneimittels als Molfraktion
∆Hf = Schmelzenthalpie (J/mol)
R = Gaskonstante (J/K∙mol)
T = gegebene Temperatur (K)
Tm = Schmelztemperatur (K)
Das Ergebnis ist die gesättigte Konzentration eines gelösten Stoffes im idealen Lösungsmittel, ausgedrückt als Molfraktion. Mit anderen Worten, dies wäre die maximal erreichbare Konzentration des Arzneimittels im bestmöglichen Lösungsmittel. In Aultons Pharmaziebuch [1] findet sich das Beispiel der Acetylsalicylsäure. Die (berechnete) ideale Löslichkeit von Acetylsalicylsäure ergibt einen Stoffmengenanteil von 0,037. Als bestes Lösungsmittel wird Tetrahydrofuran (THF) angegeben, dessen experimentell ermittelte Löslichkeit bei einem Stoffmengenanteil von 0,036 liegt. THF ist also nahezu das ideale Lösungsmittel für Acetylsalicylsäure. Es ist jedoch zu bedenken, dass die intermolekularen Wechselwirkungen die Auflösung auch begünstigen können, so dass die experimentell ermittelte Löslichkeit vermutlich höher ist als die nach der Van't-Hoffsche-Gleichung geschätzte.
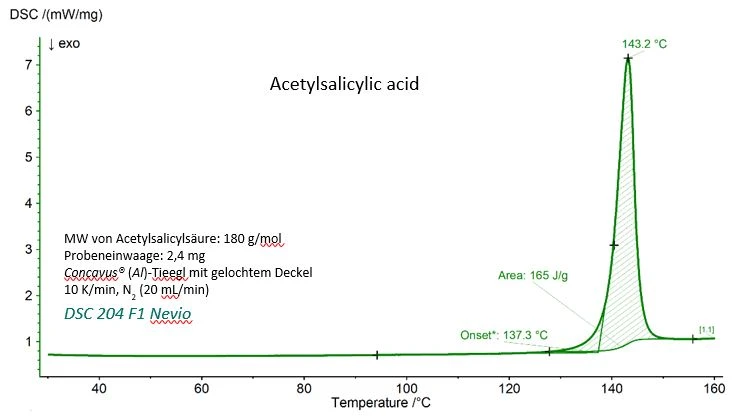
Die DSC-Kurve von Acetylsalicylsäure mit den experimentellen Werten der Schmelztemperatur, der (extrapolierten) Onset-Temperatur und der Schmelzenthalpie (Fläche unterhalb des Peaks) ist in Abbildung 1 dargestellt. Beide Werte stimmen sehr gut mit dem Referenzwert des National Institute of Standards and Technology (NIST) überein, wie aus Tabelle 1 ersichtlich ist.
Tabelle 1 – Experimentelle und Referenzwerte der Schmelztemperatur und –enthalpie von Acetylsalicylsäure.
Parameter | Experimentell | Referenz (NIST Chemistry WebBook) |
| Schmelztemperatur (extrapolierter Onset) | 410,4 K (137,3 °C) | 405±10 K |
Schmelzenthalpie (Fläche unterhalb des Peaks) | 29,7 kJ/mol (165 J/g) | 29,17 – 31,01 kJ/mol |
Aspirin (nist.gov) https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
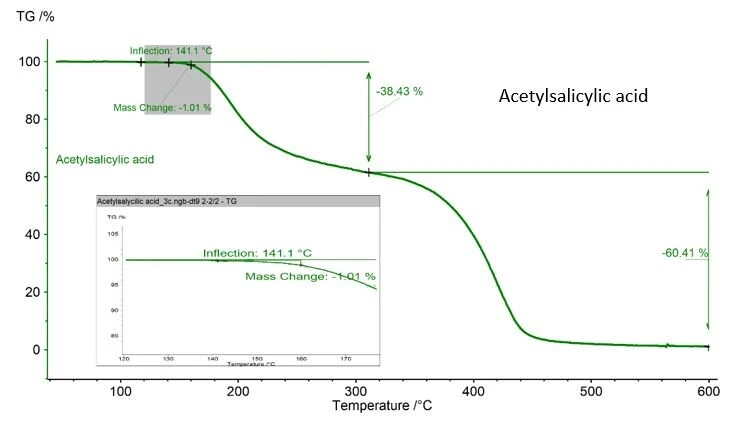
Vorsicht ist geboten, wenn die analysierte Substanz während der DSC-Messung möglicherweise thermisch abgebaut wird. Beim hier gezeigten Beispiel von Acetylsilcylsäure ist ein Massenverlust von 1,01 % zu verzeichnen, bestimmt mit einer NETZSCH-TG (Abbildung 2). Dieser Wert ist akzeptabel, da in ASTM928 1 % als maximaler Massenverlust im Schmelzbereich definiert wird. Ist keine TG verfügbar, ist das Wiegen von Tiegel und Probe sowohl vor als auch nach der Messung die beste Methode, um den Massenverlust zu kontrollieren.
Phasenübergänge, Fest-Fest-Wechselwirkungen, Änderungen der chemischen Zusammensetzung und Reinheitsbestimmung sind Beispiele für Anwendungen der DSC, einer empfindlichen Technik, die genaue und präzise Ergebnisse liefert.
Literatur:
[1] Aulton’s Pharmaceutics, 6th edition, ISBN: 9780702081545
Aspirin (nist.gov) https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
Fazit
Zusammenfassend lässt sich sagen, dass der Einsatz von Geräten von NETZSCH Analysieren & Prüfen zur Bestimmung der idealen Löslichkeit von Arzneimitteln im pharmazeutischen Entwicklungsprozess einen entscheidenden Beitrag leisten kann. DSC und TGA bieten wertvolle Einblicke in die thermischen Eigenschaften von Arzneimitteln und können helfen, Arzneimittelformulierungen für eine verbesserte Bioverfügbarkeit und Wirksamkeit zu optimieren.
Wenn Sie mehr darüber erfahren möchten, wie NETZSCH Analysieren & Prüfen Ihre pharmazeutische Entwicklung unterstützen kann, besuchen Sie unsere Website für weitere Informationen. Unsere Experten stehen Ihnen bei jedem Schritt zur Seite:
Kennen Sie bereits unser Applikationsbuch "Thermal Analysis in the Pharmaceutical Field"?
Dieses Buch veranschaulicht anhand einer Vielzahl von konkreten Anwendungsbeispielen, wie die entsprechenden Messungen durchzuführen sind und welche Schlussfolgerungen aus den Ergebnissen gezogen werden können. (Sprache: Englisch)

Das Buch enthält 8 Kapitel auf mehr als 260 Seiten zu:
- Methoden (DSC, TGA, STA und Gasanalyse)
- Charakterisierung von amorphen und kristallinen Phasen
- Reinheit
- Thermische StabilitätEin Material ist thermisch stabil, wenn es sich unter Temperatureinfluss nicht zersetzt. Eine Möglichkeit, die thermische Stabilität einer Substanz zu bestimmen ist die Verwendung eines TGA (thermogravimetrischer Analysator).Thermische Stabilität
- Oxidative Stabilität
- Lagerungsbedingungen und Haltbarkeitsdauer
- Polymorphismus
- Verträglichkeit