27.03.2023 by Dr. Ligia de Souza
İdeal Çözünürlüğü Belirlemek için DSC? Bana Nasıl Olduğunu Anlatın!
Diferansiyel taramalı kalorimetri (DSC), ilaç maddelerinin termal özelliklerini araştırmak için ilaç endüstrisinde yaygın olarak kullanılan analitik bir tekniktir. DSC'nin temel uygulamalarından biri, etkili ve güvenli farmasötik formülasyonlar geliştirmek için çok önemli olan bir ilacın ideal çözünürlüğünü belirlemektir. Bu makalede, ilaçların ideal çözünürlüğünü belirlemek için DSC'nin nasıl kullanılabileceğini ve çözünürlük davranışını etkileyebilecek faktörleri inceleyeceğiz. İster ilaç endüstrisinde bir araştırmacıarcister bilim insanı veya formülatör olun, bu makale size ideal çözünürlüğün belirlenmesi için NETZSCH Analyzing & Testing tarafından DSC cihazının kullanımı hakkında değerli bilgiler sağlayacaktır. Öyleyse, hadi bu konuya dalalım!
İlaçların Çözünürlüklerine Göre Sınıflandırılması
Çözünme hızı ilacın biyoyararlanımını doğrudan etkilediğinden, bir ilacın terapötik hedefine ulaşması için sulu çözünürlük esastır. Amerika Birleşik Devletleri Farmakopesi ve Avrupa Farmakopesi ilaçları mg/ml cinsinden yaklaşık çözünürlük aralıklarına göre sınıflandırır. Örneğin, 100-1000 mg/ml serbestçe çözülebildiği düşünülen bir molekül için çözünürlük aralığıdır ve 0,1-1 mg/ml çok az suda çözünürlük ile karakterize edilen bir ilaç molekülü için aralıktır. Bu nedenle, sulu ve susuz çözünürlüğün belirlenmesi, iyi bir ilaç adayı için mümkün olan en iyi formülasyon yaklaşımını tanımlayacaktır.
İdeal çözünürlük, ideal bir çözücü kullanıldığında, yani çözünme işlemi sırasında herhangi bir enerji kaybı olmadan bir çözücü içinde çözünen bir çözünenin teorik durumu söz konusu olduğunda, mol kesri cinsinden bir çözünenin doymuş konsantrasyonunu verir. Pratikte bu mümkün değildir çünkü çözünen-çözücü etkileşimi genellikle ideal değildir ve çözünen ile çözücü arasındaki kimyasal etkileşim çözünme sürecini engelleyebilir. Bu moleküller arası etkileşimlere örnek olarak hidrojen bağları, dielektrik özellikler ve dipol moment verilebilir.
Bir molekülün çözünürlüğünü belirlemek için tercih edilen yöntem UV spektrofotometresi olsa da, maddeninErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime noktası ve füzyon entalpisi biliniyorsa ideal çözünürlük hesaplanabilir.
Ancak, Termodinamik Terimlerle İdeal Çözünürlük Ne Anlama Gelir?
Çözünme sürecinde, çözünen-çözünmeyen bağlarının kırılması gerekir. Bu bağları kırmak için gereken enerji girdisi, bir katıyı eritmek için gereken enerjiye, yani füzyon entalpisine(∆Hf) eşittir. Öte yandan, çözünen-çözücü bağları oluşurken çözücü-çözücü bağlarının da kırılması gerekir. Bu son adım için enerji girdisi karıştırma entalpisi(∆Hmix) olarak adlandırılabilir. Böylece, çözünme entalpisi, füzyon entalpisi ve karışım entalpisinin toplamıdır:
∆Hsol = ∆Hf + ∆Hmix
Karışma entalpisi sıfıra eşitse, çözünme entalpisi füzyon entalpisine eşittir:
∆Hsol = ∆Hf
Bunlar, kristal bir malzemenin ideal çözünmesi için temel termodinamik varsayımlardır. İdeal çözünme ideal çözünürlüğe yol açar.
Diğer varsayımlar ∆Hf 'nin pozitif olduğu (füzyon EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik bir olaydır) ve ∆Hsol'ün de öyle olduğudur. Ancak, kendiliğinden bir reaksiyonun gerçekleşmesi için Gibbs serbest enerjisi(∆G = ∆Hf -T∆S)negatif olmalıdır; dolayısıyla entropi(S) pozitif olmalıdır. Erime sıcaklığı ve füzyon entalpisinin deneysel sıcaklıktan bağımsız olduğu ve çözünmenin doymuş bir çözelti sağlayacağı düşünüldüğünde Van't Hoff denklemi aşağıdaki gibi uygulanabilir:
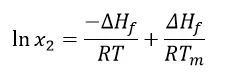
Burada: x2 = mol kesri birimlerinde ilacın doymuş konsantrasyonu
∆Hf = füzyon entalpisi (J/mol)
r = gaz sabiti (J/K∙mol)
t = verilen sıcaklık (K)
tm = erime sıcaklığı (K)
Sonuç, bir çözünenin ideal çözücüdeki doymuş konsantrasyonunu mol kesri cinsinden verir. Başka bir deyişle, bu, ilacın mümkün olan en iyi çözücüde ulaşılabilecek maksimum konsantrasyonu olacaktır. Aulton'un Farmasötik kitabında [1] asetilsalisilik asit örneği verilmiştir. Asetilsalisilik asidin (hesaplanan) ideal çözünürlüğü 0.037 mol fraksiyonudur; listelenen en iyi çözücü, deneysel olarak belirlenen çözünürlüğü 0.036 mol fraksiyonu olan tetrahidrofurandır (THF). Dolayısıyla THF, asetilsalisilik asit için ideal çözücü olmaya yakındır. Ancak, moleküller arası etkileşimlerin de çözünmeyi destekleyerek Van't Hoff denklemiyle tahmin edilenden daha yüksek deneysel çözünürlük sağlayabileceğini akılda tutmak önemlidir.
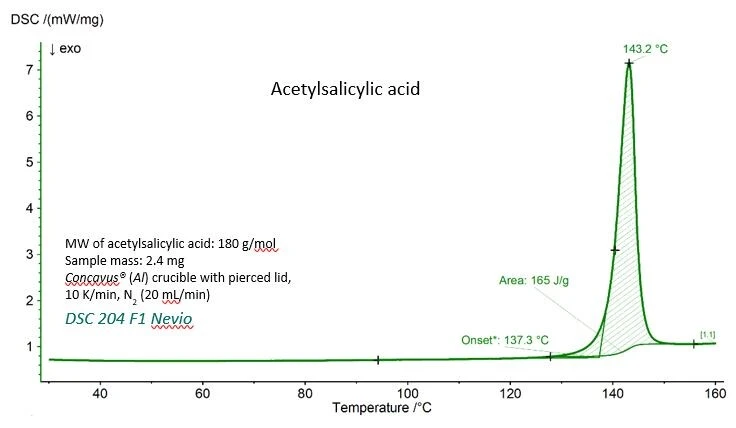
Asetilsalisilik asit için DSC eğrisi ileErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime sıcaklığı (ekstrapole edilmiş başlangıç sıcaklığı) ve füzyon entalpisi (pikin altındaki alan) için deneysel değerler şekil 1'de gösterilmiştir. Tablo 1'de görülebileceği gibi, her iki değer de Ulusal Standartlar ve Teknoloji Enstitüsü (NIST) tarafından verilen referans değerlerle çok iyi uyum göstermektedir.
Tablo 1 - Asetilsalisilik asit içinErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime sıcaklığı ve füzyon entalpisi için deneysel ve referans değerler.
Parametre | Deneysel | Referans (NIST Chemistry WebBook) |
| Ölçüm sıcaklığı (ekstrapole edilmiş başlangıç) | 410.4 K (137,3 °C) | 405±10 K |
Füzyon entalpisi (pikin altındaki alan) | 29.7 kJ/mol (165 J/g) | 29.17 - 31,01 kJ/mol |
Aspirin (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
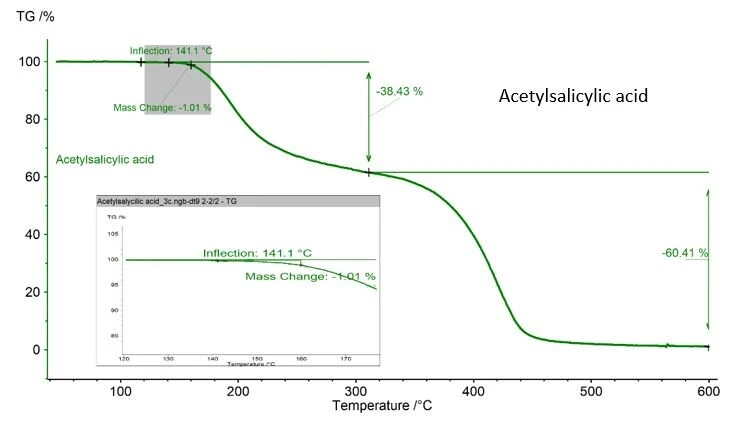
Analiz edilen madde DSC ölçümü sırasında muhtemelen termal bozunmaya uğrayacaksa dikkatli olunmalıdır. Burada gösterilen asetilsalisilik asit örneğinde, NETZSCH TGA ile belirlenen %1,01'lik bir kütle kaybı kaydedilmiştir, şekil 2. ASTM 928Erime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime aralığında maksimum kütle olarak %1'i öngördüğü için bu değer kabul edilebilir. TGA mevcut değilse, ölçümden önce ve sonra krozeyi ve numuneyi tartmak kütle kaybını izlemenin en iyi yoludur.
Faz geçişleri, katı-katı etkileşimi, kimyasal bileşimdeki değişiklikler ve purity determination, doğru ve kesin sonuçlar sağlayan hassas bir teknik olan DSC'nin uygulama örnekleridir.
Referans:
[1] Aulton's Pharmaceutics,6. baskı, ISBN: 9780702081545
Aspirin (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
Özet
Sonuç olarak, NETZSCH Analyzing & Testing cihazlarının kullanımı, farmasötik geliştirme sürecinde ilaçların ideal çözünürlüğünün belirlenmesine önemli ölçüde katkıda bulunabilir. DSC ve TGA, ilaç maddelerinin termal özellikleri hakkında değerli bilgiler sağlayarak formülatörlerin ve bilim insanlarının ilaç formülasyonlarını daha iyi biyoyararlanım ve etkinlik için optimize etmelerine yardımcı olabilir.
NETZSCH Analyzing & Testing'in farmasötik geliştirme ihtiyaçlarınızı nasıl destekleyebileceği hakkında daha fazla bilgi edinmek istiyorsanız, daha fazla bilgi için web sitemizi ziyaret edin. Uzmanlarımız size her adımda yardımcı olmak için buradalar.
"Farmasötik Alanda Termal Analiz" Uygulama Kitabımızı zaten biliyor musunuz?
Bu uygulama kitabı, ilgili deneylerin nasıl yapılacağını ve sonuçlardan hangi sonuçların çıkarılabileceğini göstermek için çeşitli özel uygulama örnekleri kullanmaktadır.

Kitap 260 sayfadan fazla sekiz bölümden oluşmaktadır:
- Termal analiz yöntemleri (DSC, TGA, STA ve Gaz Analizi)
- Amorf ve kristalin fazların karakterizasyonu
- Saflık
- Termal kararlılık
- Oksidatif stabilite
- Saklama koşulları ve raf ömrü
- Polimorfizm ve Uyumluluk