Princípio funcional de um DSC de fluxo de calor
Uma célula de medição DSC consiste em um forno e um sensor integrado com posições designadas para os recipientes de amostra e de referência.
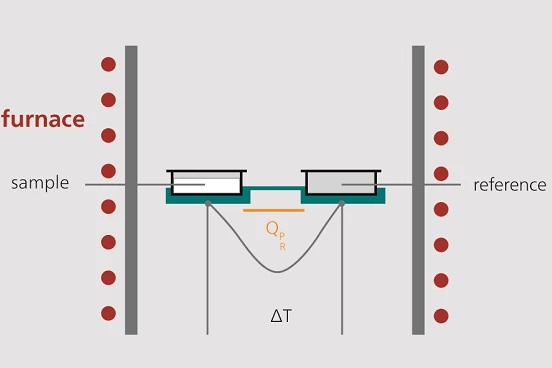
As áreas do sensor são conectadas a termopares ou podem até mesmo fazer parte do termopar. Isso permite registrar a diferença de temperatura entre a amostra e o lado de referência (sinal DSC) e a temperatura absoluta da amostra ou do lado de referência.
Devido à capacidade de calor (Capacidade térmica específica (cp)A capacidade térmica é uma quantidade física específica do material, determinada pela quantidade de calor fornecida à amostra, dividida pelo aumento de temperatura resultante. A capacidade de calor específica está relacionada a uma unidade de massa do corpo de prova.cp) da amostra, o lado de referência (normalmente uma panela vazia) geralmente aquece mais rápido do que o lado da amostra durante o aquecimento da célula de medição DSC; ou seja, a temperatura de referência (TR, verde) aumenta um pouco mais rápido do que a temperatura da amostra (TP, vermelho). As duas curvas apresentam comportamento paralelo durante o aquecimento em uma taxa de aquecimento constante, até que ocorra uma reação na amostra. No caso mostrado aqui, a amostra começa a derreter em t1. A temperatura da amostra não muda durante aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão; a temperatura do lado de referência, no entanto, não é afetada e continua exibindo um aumento linear. Quando aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão é concluída, a temperatura da amostra também começa a aumentar novamente e, a partir do ponto no tempo t2, apresenta novamente um aumento linear.
O sinal diferencial (ΔT) das duas curvas de temperatura é apresentado na parte inferior da imagem. Na seção central da curva, o cálculo das diferenças gera um pico (azul) que representa o processo deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão endotérmica. Dependendo do fato de a temperatura de referência ter sido subtraída da temperatura da amostra ou vice-versa durante esse cálculo, o pico gerado pode apontar para cima ou para baixo nos gráficos. A área do pico está correlacionada com o conteúdo de calor da transição (entalpia em J/g).
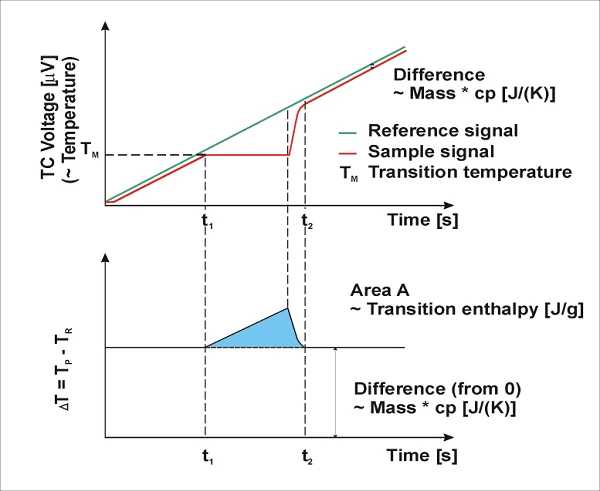
A DIN 51007 e a ISO 11357-1 recomendam a representação de processos endotérmicos com amplitude ordenada para cima. Nas normas ASTM E793 e E794, por exemplo, sugere-se a aplicação da direção endotérmica para baixo. É por isso que o software NETZSCH Proteus® permite que a direção de aplicação dos processos endotérmicos e exotérmicos seja selected.






