التحكم في العمليات الآمنة بطبيعتها
يجب أن تظل التفاعلات قابلة للتحكم في جميع الأوقات، ليس فقط على نطاق مختبري يقل عادة عن لتر واحد، ولكن أيضًا - وخاصة في المفاعلات الكبيرة التي تنتج على نطاق الأطنان. وحتى في حالة وقوع أحداث غير مخطط لها مثل تعطّل مضخة في دورة تبريد المفاعل، يجب أن تكون الاحتياطات قد اتخذت بالفعل في مرحلة التخطيط لمصنع الإنتاج لمنع خروج المفاعلات عن السيطرة. ويتيح هذا التخطيط الاستشرافي، الذي يأخذ أيضاً الأحداث غير المتوقعة في الحسبان، التشغيل الآمن بطبيعته لمحطات الإنتاج في جميع الأوقات [1].
السيناريو الأسوأ-الحالة الأسوأ
من الضروري بالفعل قبل التخطيط لمصانع الإنتاج، تقييم المواد الكيميائية المستخدمة والتفاعلات المخطط لها من حيث احتمالية خطورتها. من أجل تجنب المفاجآت غير السارة في حجم وسعة المصانع، أو في الترقية، أو حتى في ترتيب إضافة المتفاعلات، غالبًا ما يتم إجراء دراسات لهذه الغاية تصف أسوأ السيناريوهات. معرفة أسوأ الحالات يجعل من السهل التحكم في جميع ظروف الإنتاج الحقيقية. وأسوأ حالة فيما يتعلق بالتحكم في درجة حرارة المفاعل هي تجاوز درجة حرارة العملية المخطط لها بسبب، على سبيل المثال، فشل مضخة في دورة التبريد. إذا فشل نظام التبريد ولم يعد بالإمكان موازنة حرارة التفاعل، ترتفع درجة الحرارة في المفاعل فوق درجة حرارة التفاعل المخطط لها. ويمكن أن يؤدي ذلك إلى تفاعلات جانبية غير مرغوب فيها أو تفاعلات ثانوية. وفي أسوأ الحالات، يمكن أن يؤدي ارتفاع درجة الحرارة و/أو الضغط إلى انفجار المفاعل. ومن أجل التحقق مما يحدث عندما ترتفع درجة الحرارة في المفاعل بشكل لا يمكن السيطرة عليه، ومدى سرعة ارتفاع درجة الحرارة ومقدار الضغط المتراكم في المفاعل، تتم محاكاة مثل هذه التفاعلات على نطاق صغير في المختبر. والأداة المصممة لدراسة هذه الحالة الأسوأ هي NETZSCH ARC® 254.
NETZSCH ARC® 254
إن جهاز NETZSCH ARC® 254 (الشكل 1) هو مسعر معدل التسارع القادر على إجراء ما يسمى باختبارات الهرب الحراري. والهدف من تقنية القياس هذه هو إيجاد الإمكانات الخطرة فيما يتعلق بدرجة حرارة العينة أو خليط التفاعل في ظل ظروف عدم الثبات الحراري. ويعني عدم الاستاتيكية على وجه الخصوص عدم حدوث تبادل حراري. إذا بقيت كل حرارة التفاعل داخل وعاء التفاعل ولم تكن قادرة على التبدد إلى البيئة، سترتفع درجة الحرارة وبالتالي ستؤدي إلى زيادة سرعة التفاعل. سينتج عن ذلك آلية تفاعل ذاتي التسارع. من خلال دراسة مثل هذه السيناريوهات، يمكن حساب وتصنيف أي ظروف واقعية - والتي كقاعدة عامة لا تكون ثابتة الحرارة بالكامل، حيث يتم دائمًا فقدان بعض الحرارة إلى البيئة المحيطة.

كيف يتم الكشف عن تفاعل التحلل الذاتي الحراري الخارجيالتفاعل؟
وللكشف عن الهروب الحراري، يتم زيادة درجة حرارة المادة أو خليط التفاعل المراد فحصه تدريجياً. في كل خطوة من درجات الحرارة، يتم الانتظار لفترة كافية من الوقت لتلطيف درجة حرارة العينة إلى درجة الحرارة هذه. بعد ذلك، يتم إجراء الكشف عما إذا كانت درجة حرارة العينة تظل ثابتة عند درجة الحرارة هذه أو ما إذا كانت ترتفع ببطء، أي ما إذا كان التسخين الذاتي للعينة يحدث أم لا. إذا لم يتم الكشف عن أي تسخين ذاتي، يستمر هذا التسلسل من الزيادة التدريجية في درجة الحرارة (البحث الحراري-الانتظار-البحث). عند تجاوز معدل التسخين الذاتي البالغ 0.02 كلفن/دقيقة، يتغير الجهاز إلى ما يسمى بالوضع اللاهوائي. يمنع وضع القياس هذا فقدان الحرارة في بيئة العينة، لأن جميع السخانات المحيطة بحجرة العينة تتبع درجة حرارة العينة الآن. إذا كانت جميع السخانات لها نفس درجة حرارة العينة، أي أنه لا يوجد تدرج في درجة الحرارة، فلا يمكن فقدان أي حرارة إلى البيئة. وبهذه الطريقة، يضمن ARC® بيئة عينة ثابتة الحرارة إلى أقصى حد ممكن. وهذا بدوره شرط أساسي مهم لدراسة سيناريو أسوأ الحالات مثل الهروب الحراري.
كيف يتم قياس التفاعل الحراري الهارب؟
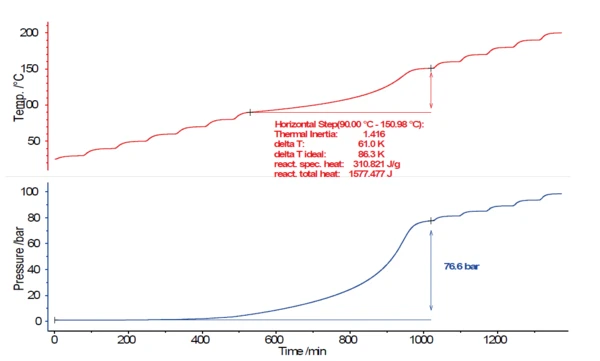
إذا بدأ الهروب الحراري في الحدوث أثناء التفاعل، فمن المستحسن تحديد هذه النقطة الزمنية أو درجة الحرارة الحرجة في أقرب وقت ممكن. عند إجراء ذلك بالتتابع، ستزداد درجة حرارة العينة في البداية ببطء شديد فقط في بداية التسخين الذاتي. 0.إن 02 K/الدقيقة هو معدل تسخين ذاتي منخفض للغاية، وهو ما يعادل 1.2 كلفن فقط في الساعة. يبدأ تفاعل التحلل ببطء، ولكن تزداد سرعته باستمرار مع ارتفاع درجة الحرارة حتى يصل إلى أقصى معدل تسخين ذاتي وأخيرًا أقصى درجة حرارة. ويوضح الشكل 3 نتائج درجة الحرارة (الأحمر) والضغط (الأزرق) لاختبار البحث عن الحرارة-انتظار-الحرارة (HWS)البحث عن الحرارة - الانتظار - البحث هو وضع قياس يُستخدم في أجهزة المسعر الحراري وفقًا لقياس المسعر الحراري بالمعدل المتسارع (ARC).HWS على محلول بيروكسيد الهيدروجين (H2O2) بنسبة 17.5%. ولهذه الغاية، وُضع حجم 5.0757 جم من محلول بيروكسيد الهيدروجين في وعاء كروي من التيتانيوم (8.7 مل).
وكما ذكرنا سابقًا، فإن معيار التعرف على تفاعل التحلل الحراري الخارجي هو معدل تسخين ذاتي > 0.02 كلفن/الدقيقة. تم تجاوز قيمة العتبة هذه عند 90 درجة مئوية (البداية)، ثم ارتفعت درجة حرارة العينة إلى 151 درجة مئوية في ظل ظروف عدم التكييف. وأثناء تفاعل التحلل، ارتفع الضغط داخل وعاء العينة إلى 76.6 بار.
هل هناك طريقة لإيقاف الهروب الحراري؟
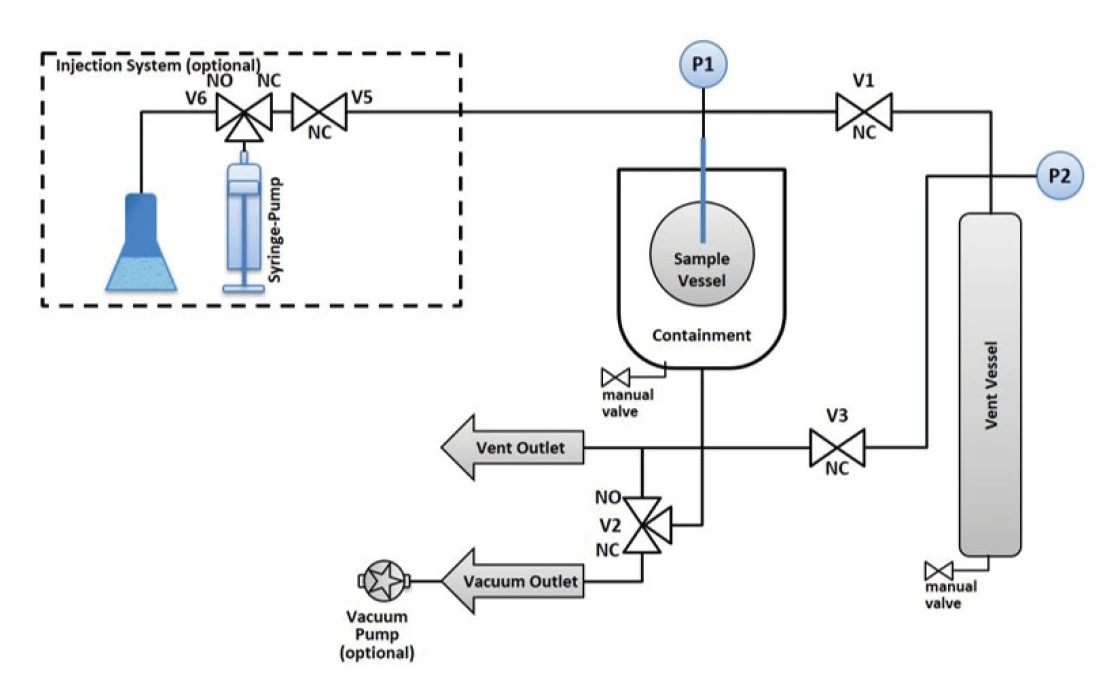
وبطبيعة الحال، ترتبط مسألة ما إذا كان يمكن إيقاف الهرب الحراري أم لا ارتباطًا وثيقًا بمعدل التسخين الذاتي. من الضروري الكشف عن درجة الحرارة الحرجة أو بداية الهرب الحراري، ولكن ربما لا يكون من المرغوب فيه دائمًا السماح لتفاعل التحلل بأن يأخذ مجراه بالكامل. سيكون من الأهم من ذلك بكثير معرفة درجة الحرارة أو الضغط الذي يمكن من خلاله إيقاف التفاعل الذي بدأ بالفعل في الهرب مرة أخرى والسيطرة عليه. إن إمكانية الكشف عن بداية الهروب الحراري للتفاعل ومن ثم منع المزيد من التسخين الذاتي عن طريق إيقاف البيئة الثابتة، وبالتالي تجنب تفاعل التحلل، قد تم الإبلاغ عنها بالفعل في مكان آخر [2]. وهنا، ينبغي محاولة إظهار طريقة أخرى لإيقاف تفاعل التحلل الذي بدأ للتو من خلال اتباع استراتيجية مختلفة. يتم توصيل وعاء التفاعل عبر خط ضغط وصمام إلى وعاء آخر، ما يسمى وعاء التنفيس (الشكل 3). عندما يتم الوصول إلى ضغط عينة يمكن اختياره بحرية، يفتح برنامج القياس الصمام إلى وعاء التنفيس. من خلال التنفيس في هذا الوعاء، يجب أن ينخفض الضغط في وعاء التفاعل أيضًا. قد يكون هذا كافياً لوقف التسخين الذاتي وبالتالي التفاعلات المتتالية والجانبية غير المنضبطة.
التنفيس
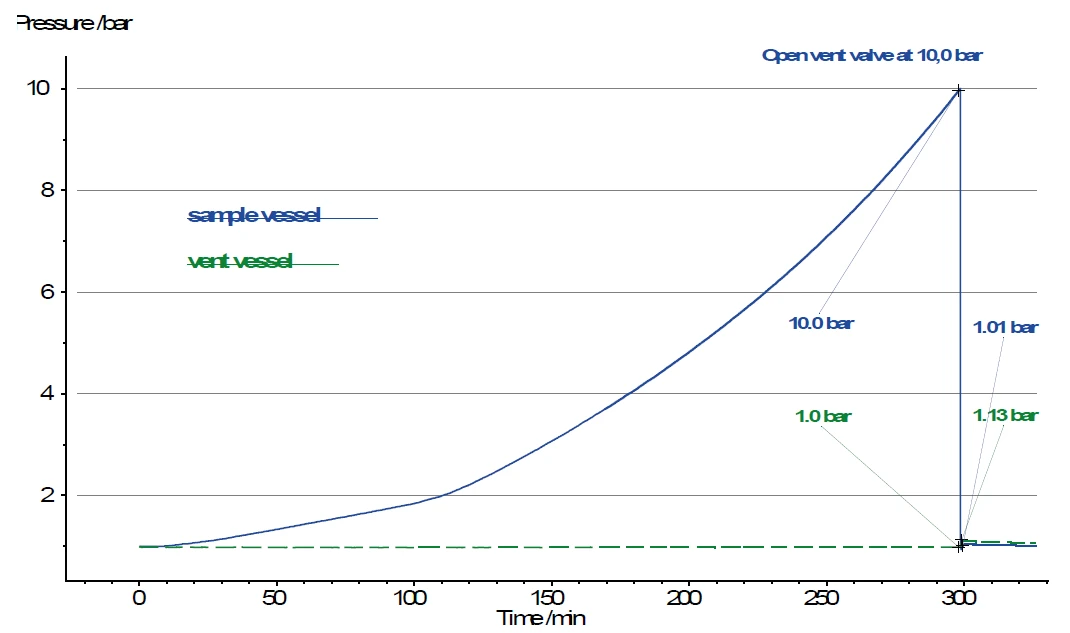
تم تجهيز كل من وعاء التفاعل ووعاء التنفيس بمقياس ضغط مستقل. وبالتالي، يمكن تتبع زيادة الضغط بعد فتح الصمام (انظر V1 في الشكل 3). ومع ذلك، فإن حجم وعاء التنفيس عند 250 مل أكبر بعدة مرات من حجم وعاء العينة، حيث يبقى عادةً حوالي 5 مل من حجم الغاز فوق العينة. ولهذا السبب، يزداد الضغط في وعاء التنفيس فقط من 1.0 بار إلى 1.13 بار بعد فتح الصمام، بينما ينخفض الضغط في وعاء العينة من 10.0 بار إلى 1.0 بار في الوقت نفسه (الشكل 4).
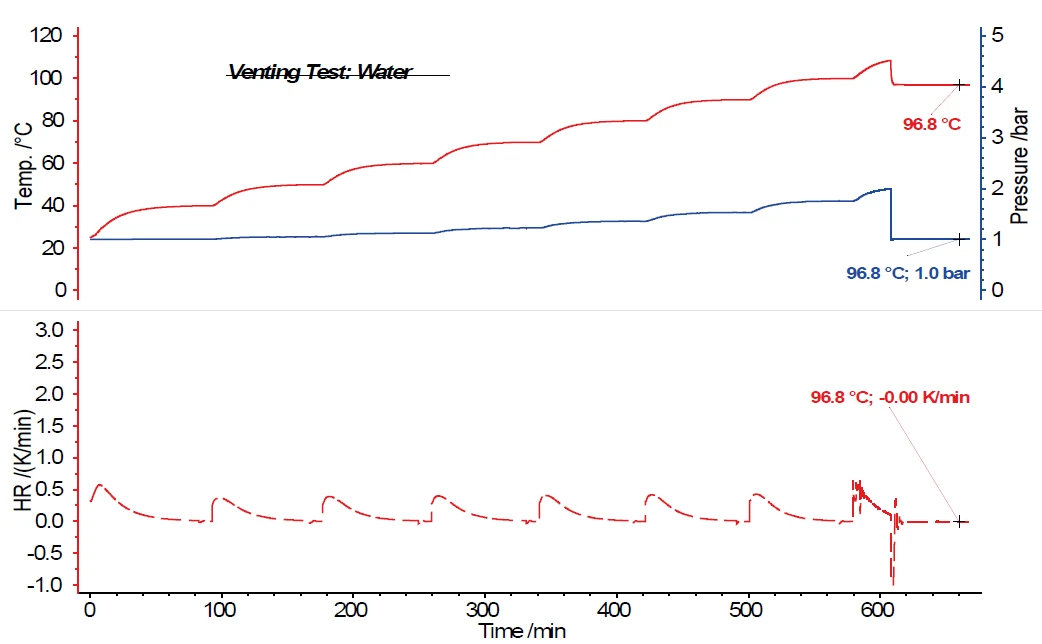
يوضح الشكل 5 نتائج قياس البحث عن الحرارة-انتظار-الحرارة (HWS)البحث عن الحرارة - الانتظار - البحث هو وضع قياس يُستخدم في أجهزة المسعر الحراري وفقًا لقياس المسعر الحراري بالمعدل المتسارع (ARC).HWS مع الماء كمادة العينة، حيث تزداد إشارة الضغط بشكل مماثل لإشارة درجة الحرارة ووفقًا لخطوات درجة الحرارة في برنامج البحث عن الحرارة-انتظار-الحرارة (HWS)البحث عن الحرارة - الانتظار - البحث هو وضع قياس يُستخدم في أجهزة المسعر الحراري وفقًا لقياس المسعر الحراري بالمعدل المتسارع (ARC).HWS. في هذا المثال، تمت برمجة فتح صمام التنفيس عبر برنامج القياس عند 2.0 بار. يمكن بسهولة ملاحظة أنه من خلال فتح وعاء التنفيس، لا ينخفض الضغط في وعاء العينة من 2.0 بار إلى 1.0 بار فحسب، بل تنخفض درجة الحرارة في وعاء العينة بشدة أيضًا. على مدار فترة 60 دقيقة يظل فيها صمام التنفيس مفتوحًا، تتبع السخانات المحيطة بالمسعر أيضًا درجة حرارة العينة. ينخفض هذا من 108.4 درجة مئوية إلى 96.8 درجة مئوية - وعلى الرغم من أن وضع القياس اللاهوائي يظل نشطًا خلال هذا الوقت، أي أن السخانات المحيطة تتبع درجة حرارة العينة - لا يمكن تحديد أي زيادة أخرى في درجة حرارة العينة.
والآن، عند فحص الماء كمادة للعينة، يمكن توقع عدم وجود تفاعل حراري خارجي. وبدلاً من ذلك، تم التأكد من أنه في حالة عدم وجود تفاعل حراري خارجي من قبل العينة، تنخفض درجة حرارة العينة بعد فتح صمام التنفيس ثم تظل ثابتة بسبب السخونة المحيطة. وهذا ما يؤكده أيضًا معدل التسخين الذاتي للعينة في الجزء السفلي من الشكل.
كما يُظهر فحص محلول بيروكسيد الهيدروجين بنسبة واحد في المائة عدم وجود زيادة أخرى في درجة الحرارة بعد فتح صمام التنفيس عند ضغط 3 بار في وعاء العينة. في حالة محلول بيروكسيد الهيدروجين بنسبة اثنين في المائة، يمكن بالفعل ملاحظة أن تفاعل التحلل الحراري الخارجي الناجم عن فتح صمام التنفيس وخفض ضغط النظام إلى الضغط الجوي ليس كافيًا لمنع المزيد من التحلل تمامًا. وينتج عن ذلك معدل تسخين ذاتي قدره 0.02 كلفن/دقيقة. بالنسبة لمحلول بيروكسيد الهيدروجين بنسبة أربعة في المائة (الشكل 6)، لا يزال معدل التسخين الذاتي 0.04 كلفن/الدقيقة بعد فتح صمام التنفيس. يلخص الجدول 1 درجات الحرارة ومعدلات التسخين الذاتي لمحاليل بيروكسيد الهيدروجين التي تمت مناقشتها.
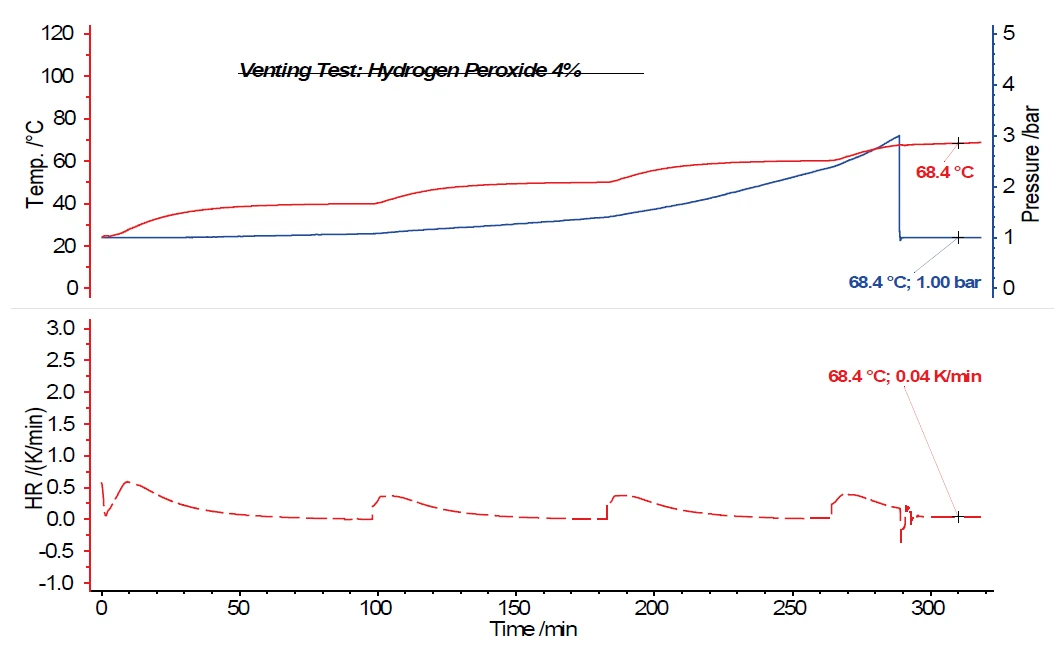
الجدول 1: ملخص درجة الحرارة ومعدل التسخين الذاتي لمختلف محاليل بيروكسيد الهيدروجين
| العينة | درجة الحرارة أثناء التنفيس | معدل التسخين الذاتي بعد التنفيس |
| H2O | 108.4 درجات مئوية (2 بار) | 0.00 كلفن/دقيقة |
| H2O2 (1%) | 81.8 درجات مئوية (3 بار) | 0.00 كلفن/دقيقة |
| H2O2 (2%) | 70.8 درجات مئوية (3 بار) | 0.02 كلفن/دقيقة |
| H2O2 (4%) | 67.6 درجات مئوية (3 بار) | 0.04 كلفن/دقيقة |
الملخص
يوفر NETZSCH ARC® 254 إمكانيتين لاستعادة السيطرة، إذا لزم الأمر، على التفاعلات التي بدأ فيها الهرب الحراري بالفعل. إحدى الإمكانيتين هي تلك التي يتم فيها إيقاف تشغيل السخانات المحيطة عندما تصل العينة إلى معدل تسخين ذاتي معين، وبالتالي القضاء على البيئة الثابتة للعينة وجعل فقدان الحرارة ممكنًا مرة أخرى؛ ومن ثم يتم تفادي المزيد من الهرب من التفاعل عن طريق هذه الفقد الحراري [2]. أما الإمكانية الأخرى، التي يمكن من خلالها إزالة الضغط من وعاء العينة إلى وعاء عينة آخر (وعاء تنفيس) عن طريق فتح صمام تنفيس الضغط (صمام تنفيس)، فقد تم تقديمها في هذه المذكرة التطبيقية. من خلال قياس الضغط بشكل مستقل، يمكن مراقبة زيادة الضغط في وعاء التنفيس. وقد تبين أنه يمكن إيقاف المزيد من التقدم في تفاعلات التحلل الحراري الخارجي الضعيف عن طريق ذلك، بينما تستمر التفاعلات الحرارية الخارجية الأكثر قوة في إظهار تسخين ذاتي يمكن اكتشافه حتى بعد تحرير الضغط.