مقدمة
تتكون بطاريات أيونات الليثيوم من كاثود وأنود وفاصل وإلكتروليت. وتتمثل وظيفة الإلكتروليت في نقل أيونات الليثيوم الموجبة بين الكاثود والأنود عبر الفاصل. وتتكون الإلكتروليتات التقليدية من ملح الليثيوم والمذيبات العضوية غير القابلة للذوبان. والإلكتروليت الأكثر استخدامًا هو سداسي فلوروفوسفات الليثيوم (LiPF6) في خليط من الكربونات الخطية والحلقية مثل كربونات الإيثيلين (EC: C3H4O3 - MM: 88.06 جم*مول-1) وكربونات ثنائي الإيثيل (DEC: C5H10O3 - MM: 118.13 جم*مول-1). يتم استخدام مزيج من LiPF6 والكربونات بسبب الموصلية العالية والقدرة على تشكيل واجهة إلكتروليت صلبة (SEI) وهو أمر ضروري لمنع المزيد من التحلل الكهربائي. ويمكنه أيضًا ضمان استمرار التفاعلات الكهروكيميائية من خلال السماح بحدوث نقل أيونات الليثيوم مع حجب الإلكترونات. هذه الأنواع من الإلكتروليتات حساسة للغاية للعوامل البيئية، ولهذا السبب يتم تشغيل هذه المواد داخل صندوق قفازات من الجو الخامل.

التفاعل الكيميائي
أحد هذه العوامل الضارة التي تؤثر على استقرار الإلكتروليت هو الماء. يمكن أن يحدث التحلل المائي لـ LiPF6 بكميات عند مستويات جزء في المليون من H2Oمما يؤدي إلى التفاعل الكيميائي متعدد الخطوات التالي LiPF6 + H2O→ HF + PF5 + LiOH → LiF + 2HF + POF3.[1] تتسبب النواتج النهائية لـ LiF وHF في حدوث مشاكل في نظام البطارية حيث أن LiF غير قابل للذوبان ومادة عازلة إلكترونياً تزيد من سماكة حاجز SEI وبالتالي زيادة المعاوقة وفقدان السعة؛ بينما يتسبب HF في أن يصبح فيلم SEI الصلب هشاً مما يؤدي إلى انتشار مذيب الكربونات على مادة الكاثود الذي بدوره يطلق الحرارة التي يمكن أن تسبب بمرور الوقت هروباً حرارياً. كما تم الإبلاغ عن التحلل الحراري للإلكتروليتات حيث يمكن أن يحدث تحلل المذيبات والتفاعلات بين أملاح الليثيوم والمذيبات عند درجات حرارة منخفضة تصل إلى 70 درجة مئوية. وبالإضافة إلى ذلك، يمكن أن تتشكل نواتج الأسترة التبادلية أيضاً من التفاعلات بين الكربونات العضوية.[2]
تجريبي
في هذه الدراسة، أُجريت العديد من التجارب من خلال تحليل TGA وDSC وتحليل الغاز المتطور للتحقق من ثبات 1.0 ميلي فلوريد LiPF6 في EC/DEC=50/50 (v/v) الذي تم الحصول عليه من Sigma-Aldrich. تم تحضير العينات في كيس قفازات مطهر بالأرجون باستخدام ما يقرب من 8-10 ملجم من محلول الإلكتروليت الذي تم وضعه في بوتقات ألومنيوم سعة 40 ميكرولترًا تم إغلاقها بأغطية بوتقة من الألومنيوم مزودة بفتحة مثقوبة بالليزر بمقدار 50 ميكرومتر للسماح للغازات بالتنفيس. تم تعريض عينة الإلكتروليت لكميات متفاوتة من الوقت للجو المحيط (N2،O2، H2O، H2O،CO2، إلخ) قبل الاختبار.
النتائج والمناقشة
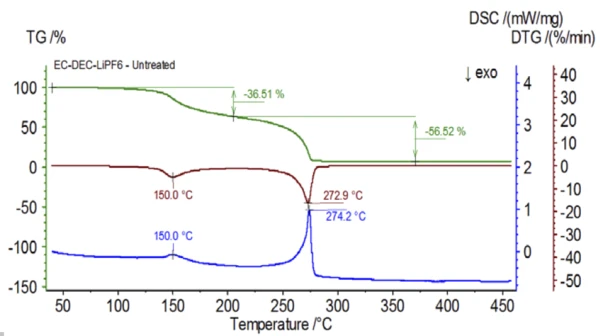
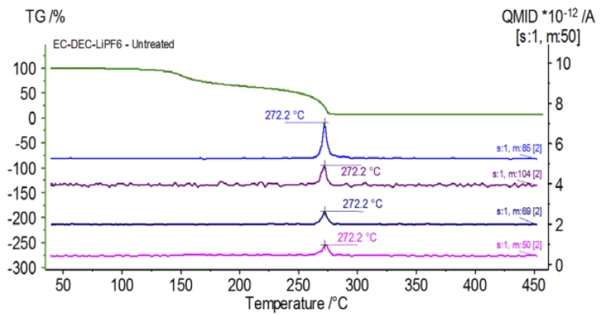
تم إعداد التجربة الأولية في كيس القفازات وتحميلها على الفور في NETZSCH STA 449 F1 Jupiter® المقترن بجهاز QMS 403 Aëolos® (الشكل 1) دون التعرض للجو المحيط من أجل الحصول على الخواص الكامنة في محلول الإلكتروليت. وتظهر منحنيات TGA وDTG وDTG وDSC لهذه العينة غير المعالجة في الشكل 2. أظهرت العينة خطوتين لفقدان الكتلة بنسبة 93.03% بالإضافة إلى قمتين ماصتين للحرارة. بالإضافة إلى ذلك، تم الكشف عن قمم في DTG (معدل تغير الكتلة - %/الدقيقة) عند 150 درجة مئوية و275 درجة مئوية تقريبًا.
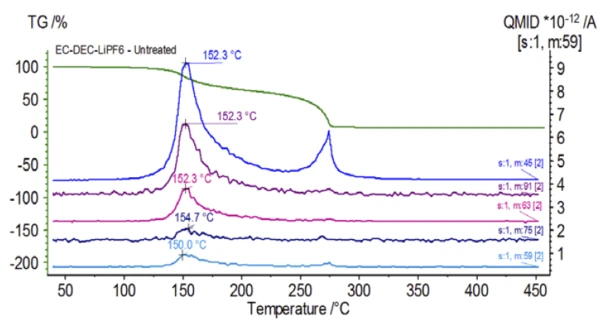
يظهر في الشكل 3 طيف الكتلة من قاعدة بيانات مكتبة المعهد الوطني للمعايير والتكنولوجيا النووية لكربونات الإيثيلين وكربونات ثنائي الإيثيلين. تم تتبع أرقام كتل مختارة تتوافق مع ثنائي إيثيل الكربونات (45 و59 و63 و75 و91) كما هو موضح في الشكل 4 مما يشير إلى أن الخطوةالأولى لفقدان الكتلة كانت على الأرجح تبخر ثنائي إيثيل الكربونات.
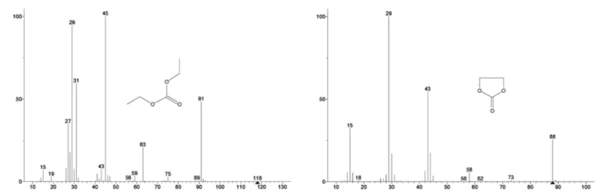
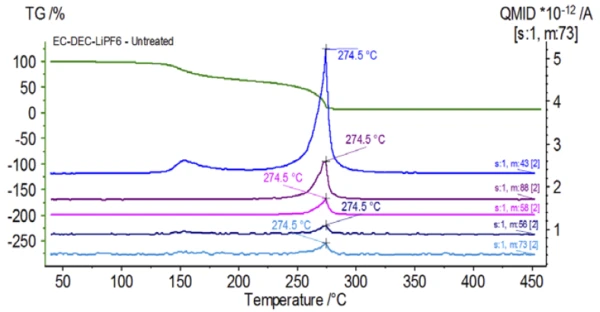
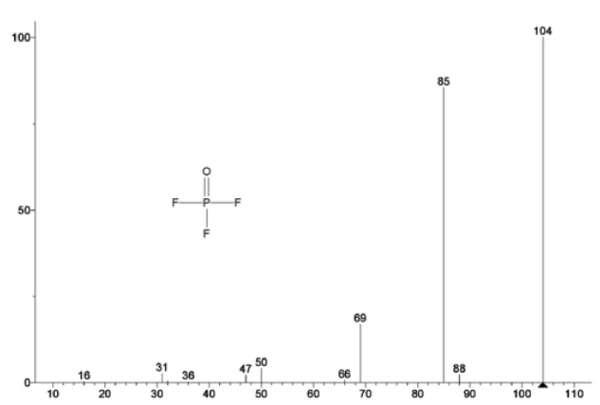
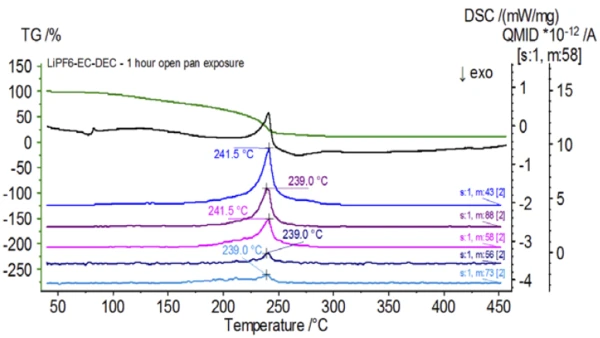
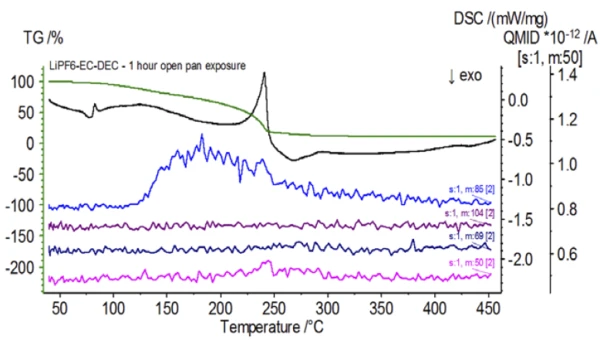
يتتبع الشكل 5 الأعداد الكتلية المنسوبة إلى كربونات الإيثيلين (43 و56 و58 و73 و88) مما يشير إلى احتمال تبخر كربونات الإيثيلين خلال خطوة فقدان الكتلةالثانية. علاوةً على ذلك، أظهرت أيضًا الأعداد الكتلية 50 و69 و85 و104 المقابلة لـ POF3 (الطيف الكتلي المعروض في الشكل 6) قممًا عند درجة حرارة 275 درجة مئوية (خطوة فقدان الكتلة الثانية) الموضحة في الشكل 7، مما يشير إلى احتمال تحلل LiPF6.
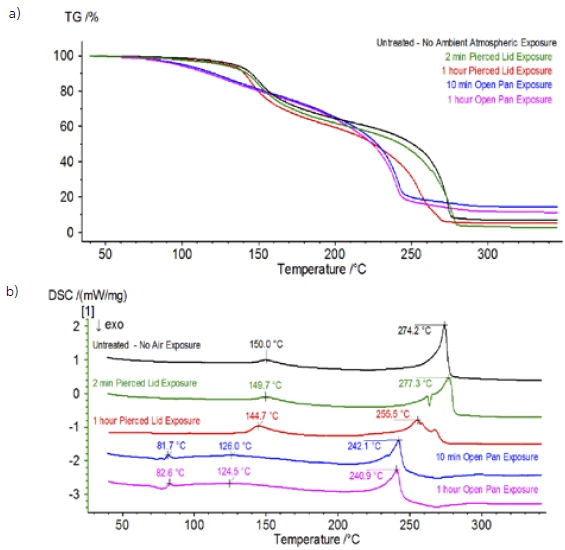
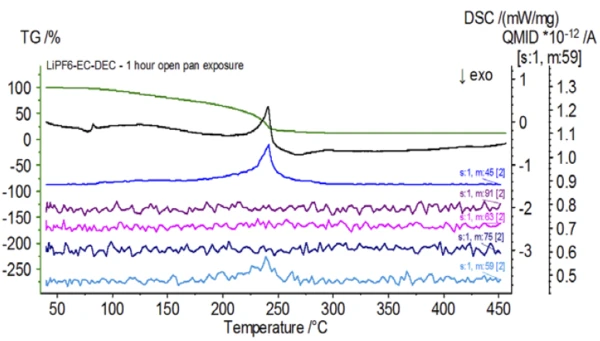
عند الانتهاء من العينة غير المعالجة، والتي تم تحضيرها في ظروف خاملة، تم تعريض كل عينة متتالية لدرجات متفاوتة من التعرض للغلاف الجوي المحيط قبل الاختبار. أعدت التجربة الأولى العينة في كيس القفازات الخامل مع إغلاق البوتقة بغطاء مثقوب، ولكن قبل الاختبار تم تعريض العينة للجو المحيط لمدة دقيقتين قبل التحميل للاختبار. حاكى التكرار الثاني التجربة الأولى باستثناء التعرض لمدة ساعة واحدة. بالنسبة للتجربة الثالثة، بدلًا من غلق البوتقة داخل كيس القفازات، تمت إزالة وعاء الألومنيوم المفتوح وتعريضه بالكامل للجو المحيط لمدة 10 دقائق قبل وضع الغطاء المثقوب فوق البوتقة ثم الغلق. اتبعت التجربة الأخيرة إجراء التجربة الثالثة، لكنها مددت وقت التعرض إلى ساعة واحدة. تظهر نتائج جميع التكرارات بما في ذلك العينة غير المعالجة في الشكل 8. بالنسبة للعينة التي تم تعريضها لمدة دقيقتين بغطاء مثقوب، والذي تم تصميمه لتقليل المواد المتطايرة في العينة من التسرب وكذلك للحد من دخول الغلاف الجوي المحيط، تُظهر منحنيات TGA وDSC ملامح مماثلة للعينة غير المعالجة؛ ومع ذلك هناك اختلافات صغيرة ودقيقة مثل الطاقة الماصة للحرارة المزدوجة المحتملة في منحنى DSC إلى جانب انزياح طفيف في الخطوةالثانية لفقدان الكتلة في منحنى TGA والتي قد تشير إلى أن عينة الاختبار قد تعرضت للخطر مع التعرض القصير للغلاف الجوي المحيط. ومع زيادة مدة التعرض للغلاف الجوي في التجربةالثانية، تُظهر العينة التي استغرقت ساعة واحدة بوضوح مزيدًا من الانحرافات في منحنى TGA، كما أن لديها انزياحًا أكثر وضوحًا في الخطوة الثانية من منحنى DSC النشط. أدى التعريض غير المقيد لمدة 10 دقائق من بوتقة مفتوحة إلى تغيير كامل تعقيد الإلكتروليت بشكل أساسي حيث شوهدت ذرات إضافية في منحنى DSC لم تكن موجودة في العينة غير المعالجة بينما تحولت الذروة الماصة للحرارة الأخيرة إلى درجات حرارة أقل. كما أظهر اختبار TGA أيضًا تبخر/تحلل يبدأ عند درجات حرارة منخفضة، وملامح فقدان كتلة مختلفة وكميات فقدان كتلة نهائية مختلفة تمامًا (تم أخذ كتلة العينة الأولية المدخلة بعد انقضاء مدة تعريض العينة). تم أيضًا اقتران العينة المكشوفة بالكامل لمدة ساعة واحدة مع نظام قياس الكمية حيث تم رصد نفس أعداد الكتلة مقارنة بالعينة غير المعالجة. لم تعد الأعداد الكتلية المنسوبة إلى ثنائي إيثيل الكربونات (45 و59 و63 و75 و91) تظهر نشاطًا في العينة المكشوفة (الشكل 9) عند مقارنتها بالعينة غير المعالجة (الشكل 4) مما يشير إلى تغيرات تركيبية أدت إلى نواتج تحلل مختلفة. ويتتبع الشكل 10 الأعداد الكتلية المقابلة لكربونات الإيثيلين (43 و56 و58 و73 و88) مما يشير إلى تطورها المحتمل، ولكن تبلغ ذروتها عند درجة حرارة أقل بنحو 30 درجة مئوية من العينة غير المعالجة. ويمكن رؤية المزيد من الأدلة على التغيرات التركيبية في العينة المكشوفة حيث لم تعد الأعداد الكتلية المرتبطة بـ POF3 (50 و69 و85 و104) تتطور (الشكل 11).
الملخص
يجب تخزين العينات الحساسة للجو المحيط، مثل الإلكتروليتات المستخدمة في صناعة بطاريات أيونات الليثيوم وتجهيزها بحذر. فحتى الحد الأدنى من التعرض يمكن أن يبدأ في إحداث تغيرات في المادة مما يؤدي إلى تأثيرات ضارة وغير مرغوب فيها كما هو واضح في تحليل TGA وDSC وتحليل الغاز المتطور.