Wprowadzenie
Baterie litowo-jonowe składają się z katody, anody, separatora i elektrolitu. Zadaniem elektrolitu jest transport dodatnich jonów litu między katodą a anodą przez separator. Tradycyjne elektrolity składają się z soli litu i organicznych rozpuszczalników aprotycznych. Najczęściej stosowanym elektrolitem jest heksafluorofosforan litu (LiPF6) w mieszaninie liniowych i cyklicznych węglanów, takich jak węglan etylenu (EC: C3H4O3 - MM: 88,06 g*mol-1) i węglan dietylu (DEC: C5H10O3 - MM: 118,13 g*mol-1). Połączenie LiPF6 i węglanów jest stosowane ze względu na wysoką przewodność i zdolność do tworzenia stałego interfejsu elektrolitu (SEI), co jest niezbędne, aby zapobiec dalszemu rozkładowi elektrolitu. Może również zapewnić ciągłość reakcji elektrochemicznych, umożliwiając transport jonów litu przy jednoczesnym blokowaniu elektronów. Tego typu elektrolity są niezwykle wrażliwe na czynniki środowiskowe, dlatego ich eksploatacja odbywa się w komorze rękawicowej w atmosferze obojętnej.

Reakcja chemiczna
Jednym z tych szkodliwych czynników wpływających na stabilność elektrolitu jest woda. Hydroliza LiPF6 może zachodzić w ilościach na poziomie ppmH2O, co skutkuje następującą wieloetapową reakcją chemiczną: LiPF6 +H2O→ HF + PF5 + LiOH → LiF + 2HF + POF3.[1] Produkty końcowe LiF i HF powodują problemy w systemie baterii, ponieważ LiF jest nierozpuszczalny i stanowi materiał izolujący elektronicznie, który zwiększa grubość bariery SEI, zwiększając tym samym impedancję i utratę pojemności; podczas gdy HF powoduje, że sztywna warstwa SEI staje się krucha, co prowadzi do dyfuzji rozpuszczalnika węglanowego na materiał katody, co z kolei uwalnia ciepło, które z czasem może spowodować ucieczkę termiczną. Odnotowano również degradację termiczną elektrolitów, gdzieReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład rozpuszczalnika i interakcje między solami litu i rozpuszczalnikami mogą wystąpić w temperaturach tak niskich jak 70°C. Ponadto, produkty transestryfikacji mogą również powstawać w wyniku reakcji pomiędzy węglanami organicznymi[2].
Eksperymentalny
W tym badaniu przeprowadzono kilka eksperymentów za pomocą TGA, DSC i analizy gazu ulatniającego się w celu zbadania stabilności 1,0 M LiPF6 w EC/DEC = 50/50 (v/v) nabytego od Sigma-Aldrich. Próbki przygotowano w worku rękawicowym oczyszczonym argonem przy użyciu około 8 - 10 mg roztworu elektrolitu odpipetowanego do aluminiowych tygli o pojemności 40 μl, które zostały uszczelnione aluminiowymi pokrywkami tygli z laserowo wyciętym otworem o średnicy 50 μm, aby umożliwić ujście gazów. Próbka elektrolitu była wystawiona na działanie atmosfery otoczenia (N2, O2,H2O,CO2 itp.) przez różną ilość czasu przed badaniem.
Wyniki i dyskusja
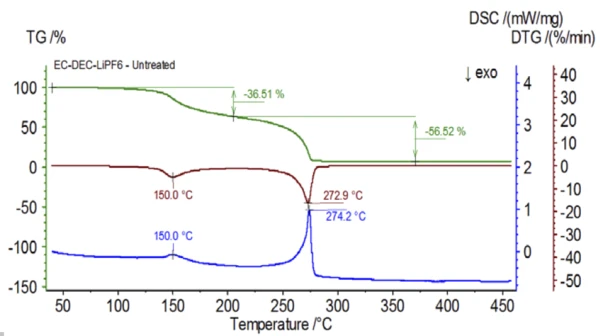
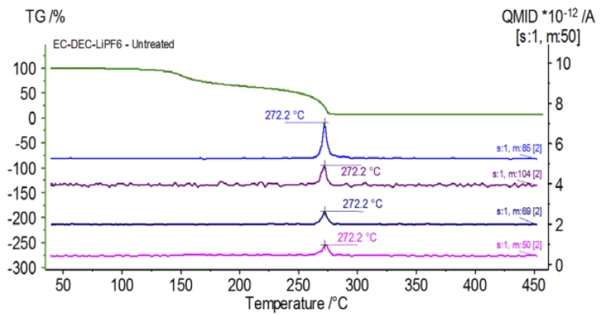
Eksperyment początkowy został przygotowany w worku rękawicowym i natychmiast załadowany do urządzenia NETZSCH STA 449 F1 Jupiter® sprzężonego z QMS 403 Aëolos® (rysunek 1) bez ekspozycji na atmosferę otoczenia w celu uzyskania nieodłącznych właściwości roztworu elektrolitu. Krzywe TGA, DTG i DSC tej nieobrobionej próbki pokazano na rysunku 2. Próbka wykazała dwa stopnie utraty masy wynoszące łącznie 93,03%, a także dwa piki endotermiczne. Ponadto wykryto piki w DTG (szybkość zmiany masy - %/min) przy około 150°C i 275°C.
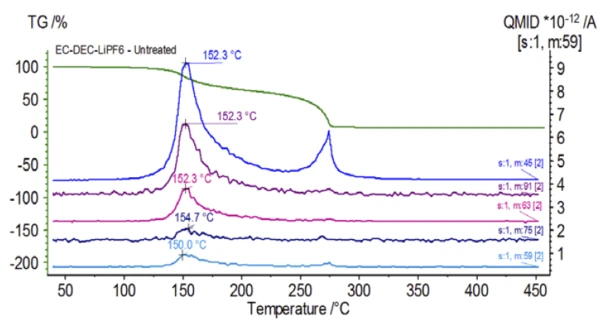
Widmo masowe z bazy danych NIST library węglanu etylenu i węglanu dietylu pokazano na rysunku 3. Select znaleziono numery mas odpowiadające węglanowi dietylu (45, 59, 63, 75 i 91), jak pokazano na rysunku 4, co wskazuje, żepierwszym etapem utraty masy było prawdopodobnie OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie DEC.
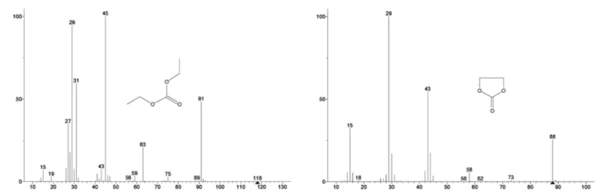
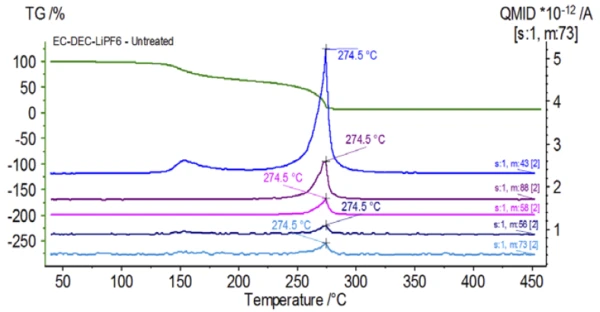
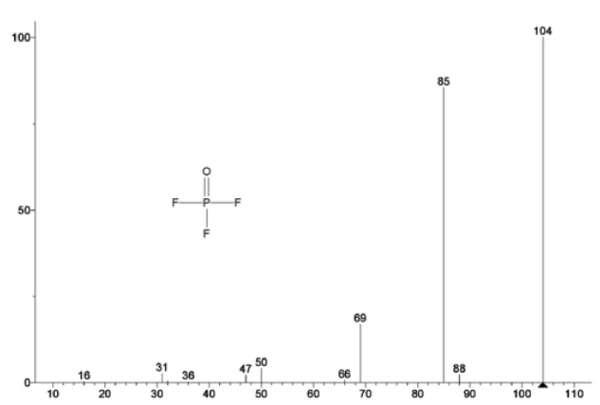
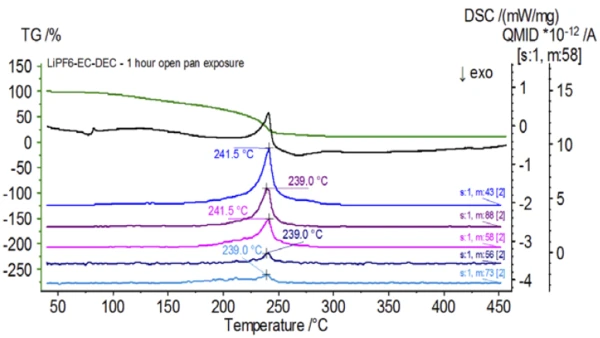
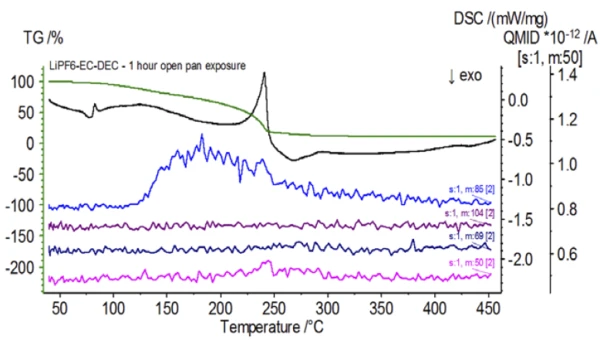
Rysunek 5 przedstawia liczby masowe przypisane węglanowi etylenu (43, 56, 58, 73 i 88) wskazujące na prawdopodobne OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie EC podczasdrugiego etapu utraty masy. Ponadto liczby masowe 50, 69, 85 i 104 odpowiadające POF3 (widmo masowe pokazane na rysunku 6) również wykazywały piki w 275 ° C (drugi etap utraty masy) pokazane na rysunku 7, co wskazuje na prawdopodobnyReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład LiPF6.
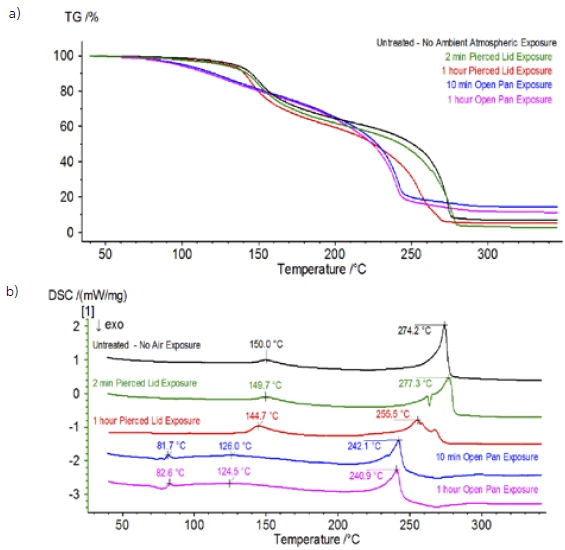
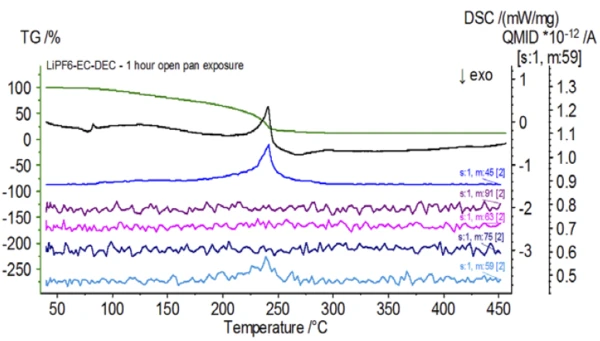
Po zakończeniu badania próbki niepoddanej obróbce, która została przygotowana w warunkach obojętnych, każda kolejna próbka została poddana działaniu atmosfery otoczenia w różnym stopniu przed badaniem. W pierwszym eksperymencie próbka została przygotowana w obojętnym worku rękawicowym z tyglem zaciśniętym za pomocą przekłutej pokrywy, ale przed badaniem próbka została wystawiona na działanie atmosfery otoczenia przez 2 minuty przed załadowaniem do badania. Druga iteracja naśladowała pierwszy eksperyment, z wyjątkiem ekspozycji przez 1 godzinę. W trzecim eksperymencie, zamiast zaciskania tygla wewnątrz worka rękawicowego, otwartą aluminiową szalkę usunięto i całkowicie wystawiono na działanie atmosfery otoczenia przez 10 minut przed umieszczeniem przekłutej pokrywy na tyglu, a następnie zaciśnięciem. W ostatnim eksperymencie zastosowano procedurę z trzeciego eksperymentu, ale wydłużono czas ekspozycji do 1 godziny. Wyniki dla wszystkich iteracji, w tym nietraktowanej próbki, pokazano na rysunku 8. W przypadku próbki poddanej ekspozycji przez okres 2 minut z przebitą pokrywą, która została zaprojektowana w celu zminimalizowania ulatniania się substancji lotnych z próbki, a także w celu ograniczenia przedostawania się atmosfery otoczenia, krzywe TGA i DSC wykazują podobne profile jak w przypadku próbki niepoddanej obróbce; istnieją jednak small subtelne różnice, takie jak możliwa podwójna endotermiczna energia na krzywej DSC wraz z niewielkim przesunięciem wdrugim etapie utraty masy na krzywej TGA, co może wskazywać, że próbka testowa została uszkodzona w wyniku krótkiej ekspozycji na atmosferę otoczenia. Wraz z wydłużeniem czasu ekspozycji na działanie atmosfery wdrugim eksperymencie, próbka 1-godzinna wyraźnie wykazuje dalsze odchylenia w krzywej TGA i ma bardziej wyraźne przesunięcie w drugim energicznym DSC. 10-minutowa nieograniczona ekspozycja z otwartego tygla zasadniczo zmieniła całą złożoność elektrolitu, ponieważ zaobserwowano dodatkowe endotermy DSC, które nie występowały w nietraktowanej próbce, podczas gdy ostatni pik EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny przesunął się do niższych temperatur. TGA wykazało również parowanie/rozkład rozpoczynający się w niższych temperaturach, inny profil utraty masy i zupełnie inne końcowe ilości utraty masy (wprowadzona początkowa masa próbki została pobrana po upływie czasu ekspozycji próbki). 1-godzinna w pełni naświetlona próbka została również podłączona do QMS, gdzie monitorowano te same liczby masowe w porównaniu z próbką niepoddaną obróbce. Liczby masowe przypisane węglanowi dietylu (45, 59, 63, 75 i 91) nie wykazywały już aktywności w eksponowanej próbce (rysunek 9) w porównaniu z próbką niepoddaną obróbce (rysunek 4), co wskazuje na zmiany składu, które spowodowały powstanie różnych produktów rozkładu. Rysunek 10 przedstawia liczby masowe odpowiadające węglanowi etylenu (43, 56, 58, 73 i 88) wskazujące na jego prawdopodobną ewolucję, ale osiągającą szczyt w temperaturze o około 30°C niższej niż w próbce niepoddanej obróbce. Dalsze dowody zmian składu w eksponowanej próbce można zaobserwować, ponieważ liczby masowe związane z POF3 (50, 69, 85 i 104) już nie ewoluują (Rysunek 11).
Podsumowanie
Próbki wrażliwe na atmosferę otoczenia, takie jak elektrolity stosowane w przemyśle akumulatorów litowo-jonowych, muszą być przechowywane i przygotowywane z zachowaniem ostrożności. Nawet minimalna ekspozycja może zacząć powodować zmiany w materiale, prowadząc do potencjalnych szkodliwych i niepożądanych efektów, jak widać w przypadku TGA, DSC i analizy gazów wydzielanych.