Introdução
As baterias de íons de lítio consistem em um cátodo, um ânodo, um separador e um eletrólito. A função do eletrólito é transportar íons positivos de lítio entre o cátodo e o ânodo através do separador. Os eletrólitos tradicionais consistem em sal de lítio e solventes orgânicos apróticos. O eletrólito mais comumente usado é o hexafluorofosfato de lítio (LiPF6) em uma mistura de carbonatos lineares e cíclicos, como o carbonato de etileno (EC: C3H4O3 - MM: 88,06 g*mol-1) e o carbonato de dietila (DEC: C5H10O3 - MM: 118,13 g*mol-1). A combinação de LiPF6 e carbonatos é usada devido à alta condutividade e à capacidade de formação de interface de eletrólito sólido (SEI), que é necessária para evitar a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição adicional do eletrólito. Ela também pode garantir a continuidade das reações eletroquímicas, permitindo que o transporte de íons de lítio ocorra enquanto bloqueia os elétrons. Esses tipos de eletrólitos são extremamente sensíveis a fatores ambientais, e é por isso que a operação dessas substâncias é realizada dentro de um porta-luvas com atmosfera inerte.

Reação química
Um desses fatores prejudiciais que afetam a estabilidade do eletrólito é a água. A hidrólise do LiPF6 pode ocorrer em quantidades nos níveis de ppm de H2O, resultando na seguinte reação química de várias etapas: LiPF6 + H2O→ HF + PF5 + LiOH → LiF + 2HF + POF3.[1] Os produtos finais de LiF e HF causam problemas no sistema de bateria, pois o LiF é insolúvel e um material eletronicamente isolante que aumenta a espessura da barreira SEI, aumentando assim a impedância e a perda de capacidade; enquanto o HF faz com que o filme rígido SEI se torne frágil, levando o solvente de carbonato a se difundir no material do cátodo, o que, por sua vez, libera calor que, com o tempo, pode causar Fuga térmicaO descontrole térmico é a situação em que um reator químico fica fora de controle em relação à produção de temperatura e/ou pressão causada pela própria reação química. A simulação de um descontrole térmico geralmente é realizada usando um dispositivo de calorímetro de acordo com a calorimetria de taxa acelerada (ARC).fuga térmica. A degradação térmica dos eletrólitos também foi relatada, onde a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição do solvente e as interações entre os sais de lítio e os solventes podem ocorrer em temperaturas tão baixas quanto 70°C. Além disso, produtos de transesterificação também podem se formar a partir de reações entre os carbonatos orgânicos[2].
Experimental
Neste estudo, vários experimentos foram realizados por meio de TGA, DSC e análise de gás evoluído para investigar a estabilidade de 1,0 M LiPF6 em EC/DEC=50/50 (v/v) adquirido da Sigma-Aldrich. As amostras foram preparadas em um saco de luvas purgado com argônio, utilizando aproximadamente 8 a 10 mg de solução de eletrólito pipetada em cadinhos de alumínio de 40 μL que foram selados com tampas de cadinho de alumínio com um orifício de 50 μm cortado a laser para permitir a saída de gases. A amostra de eletrólito foi exposta a quantidades variáveis de tempo à atmosfera ambiente (N2,O2, H2O,CO2, etc.) antes do teste.
Resultados e discussão
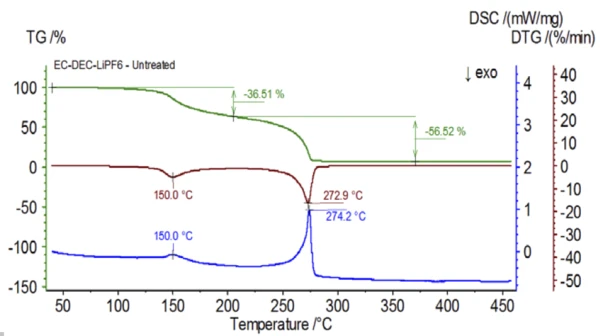
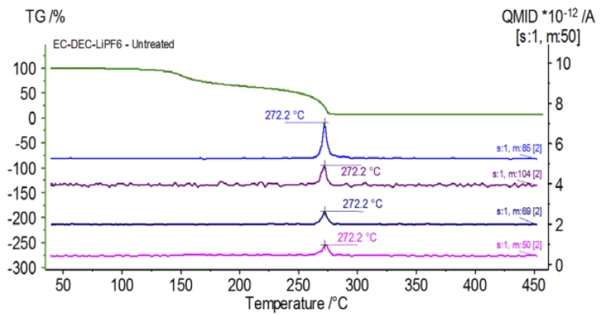
O experimento inicial foi preparado no saco de luvas e imediatamente carregado no NETZSCH STA 449 F1 Jupiter® acoplado a um QMS 403 Aëolos® (Figura 1) sem exposição à atmosfera ambiente para adquirir as propriedades inerentes da solução eletrolítica. As curvas de TGA, DTG e DSC dessa amostra não tratada são mostradas na Figura 2. A amostra apresentou duas etapas de perda de massa, totalizando 93,03%, bem como dois picos endotérmicos. Além disso, picos no DTG (taxa de mudança de massa - %/min) foram detectados a aproximadamente 150°C e 275°C.
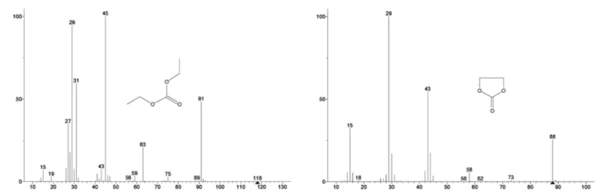
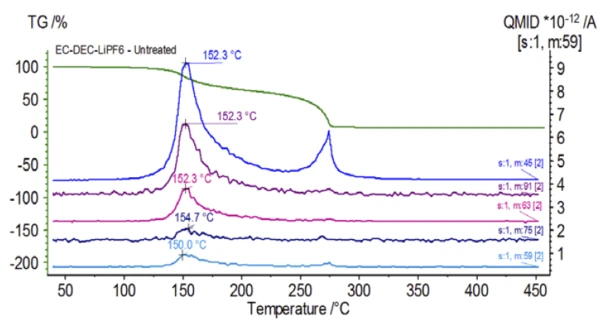
O espectro de massa do banco de dados do NIST library de carbonato de etileno e carbonato de dietila é mostrado na Figura 3. Select Os números de massa correspondentes ao carbonato de dietila foram rastreados (45, 59, 63, 75 e 91), como visto na Figura 4, indicando que aprimeira etapa de perda de massa foi provavelmente a evaporação do DEC.
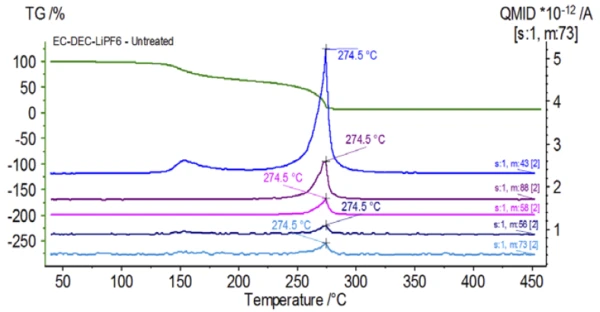
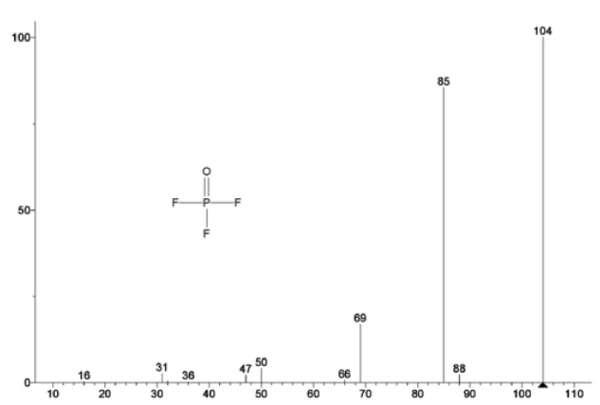
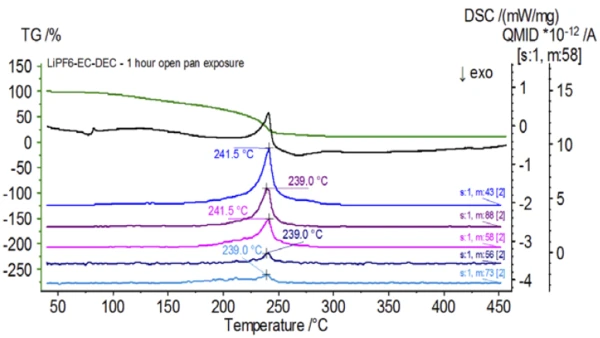
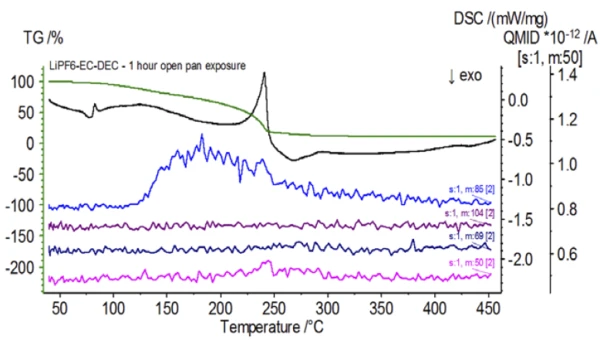
A Figura 5 mostra os números de massa atribuídos ao carbonato de etileno (43, 56, 58, 73 e 88), indicando a provável evaporação do CE durante asegunda etapa de perda de massa. Além disso, os números de massa 50, 69, 85 e 104 correspondentes ao POF3 (espectro de massa exibido na Figura 6) também exibiram picos a 275°C (2ª etapa de perda de massa) mostrados na Figura 7, indicando a provável Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição do LiPF6.
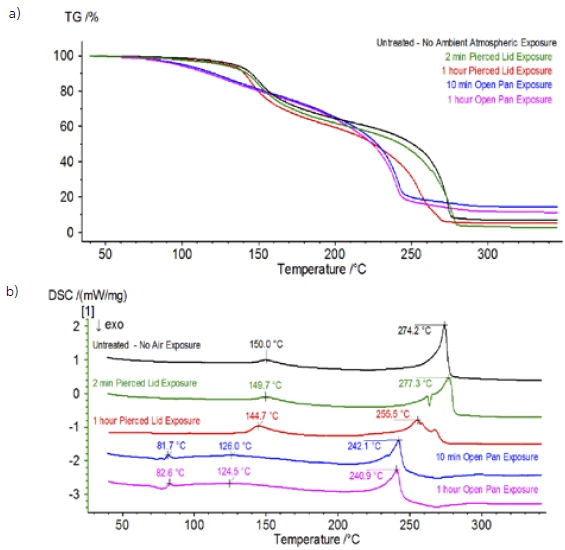
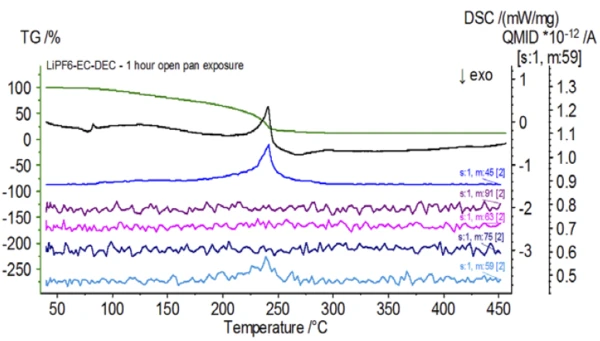
Após a conclusão da amostra não tratada, que foi preparada em condições inertes, cada amostra sucessiva foi submetida a diferentes graus de exposição à atmosfera ambiente antes do teste. O primeiro experimento preparou a amostra no saco de luvas inerte com o cadinho fechado com uma tampa perfurada, mas antes do teste a amostra foi exposta à atmosfera ambiente por 2 minutos antes de ser carregada para o teste. A segunda iteração imitou o primeiro experimento, mas a exposição foi de 1 hora. Para o terceiro experimento, em vez de crimpar o cadinho dentro do saco de luvas, a bandeja de alumínio aberta foi removida e totalmente exposta à atmosfera ambiente por 10 minutos antes de colocar a tampa perfurada sobre o cadinho e, em seguida, crimpar. O experimento final seguiu o procedimento do terceiro experimento, mas estendeu o tempo de exposição para 1 hora. Os resultados de todas as iterações, incluindo a amostra não tratada, são mostrados na Figura 8. small Para a amostra exposta por um período de 2 minutos com uma tampa perfurada, que foi projetada para minimizar a fuga de voláteis da amostra, bem como para limitar a entrada da atmosfera ambiente, as curvas de TGA e DSC mostram perfis semelhantes aos da amostra não tratada; no entanto, há diferenças sutis, como uma possível energia endotérmica dupla na curva de DSC, juntamente com uma ligeira mudança nasegunda etapa de perda de massa da curva de TGA, que pode indicar que a amostra de teste foi comprometida com a breve exposição à atmosfera ambiente. Com o aumento da duração da exposição atmosférica nosegundo experimento, a amostra de 1 hora mostra claramente mais desvios na curva de TGA e tem uma mudança mais pronunciada na última energia de DSC. Uma exposição irrestrita de 10 minutos a partir de um cadinho aberto alterou essencialmente toda a complexidade do eletrólito, pois foram observadas endotermas DSC adicionais que não estavam presentes na amostra não tratada, enquanto o último pico EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico se deslocou para temperaturas mais baixas. O TGA também mostrou evaporação/Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição começando em temperaturas mais baixas, um perfil de perda de massa diferente e quantidades finais de perda de massa completamente diferentes (a massa inicial da amostra inserida foi obtida após a exposição decorrida da amostra). A amostra de 1 hora totalmente exposta também foi acoplada ao QMS, onde os mesmos números de massa foram monitorados em comparação com a amostra não tratada. Os números de massa atribuídos ao carbonato de dietila (45, 59, 63, 75 e 91) não apresentaram mais atividade na amostra exposta (Figura 9) quando comparados com a amostra não tratada (Figura 4), indicando alterações na composição que resultaram em diferentes produtos de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição. A Figura 10 traça números de massa correspondentes ao carbonato de etileno (43, 56, 58, 73 e 88), indicando sua provável evolução, mas com pico em uma temperatura aproximadamente 30°C menor do que a da amostra não tratada. Outras evidências de mudanças na composição da amostra exposta podem ser vistas quando os números de massa associados ao POF3 (50, 69, 85 e 104) não estão mais evoluindo (Figura 11).
Resumo
As amostras sensíveis à atmosfera ambiente, como os eletrólitos usados no setor de baterias de íons de lítio, precisam ser armazenadas e preparadas com cuidado. Até mesmo uma exposição mínima pode começar a causar alterações no material, levando a possíveis efeitos prejudiciais e indesejados, conforme observado com o TGA, DSC e análise de gás evoluído.