Введение
Литий-ионные батареи состоят из катода, анода, сепаратора и электролита. Функция электролита заключается в переносе положительных ионов лития между катодом и анодом через сепаратор. Традиционные электролиты состоят из соли лития и органических апротических растворителей. Наиболее часто используемым электролитом является гексафторфосфат лития (LiPF6) в смеси с линейными и циклическими карбонатами, такими как этиленкарбонат (EC: C3H4O3 - ММ: 88,06 г*моль-1) и диэтилкарбонат (DEC: C5H10O3 - ММ: 118,13 г*моль-1). Комбинация LiPF6 и карбонатов используется из-за высокой проводимости и способности формировать твердый электролитный интерфейс (SEI), который необходим для предотвращения дальнейшего разложения электролита. Она также может обеспечить продолжение электрохимических реакций, позволяя переносить ионы лития и блокируя электроны. Эти типы электролитов чрезвычайно чувствительны к факторам окружающей среды, поэтому работа с ними проводится в перчаточном боксе с инертной атмосферой.

Химическая реакция
Одним из таких вредных факторов, влияющих на стабильность электролита, является вода. Гидролиз LiPF6 может происходить в количествах на уровне ppm в H2O, что приводит к следующей многоступенчатой химической реакции: LiPF6 + H2O→ HF + PF5 + LiOH → LiF + 2HF + POF3.[1] Конечные продукты LiF и HF вызывают проблемы в аккумуляторной системе, поскольку LiF нерастворим и является электронно-изолирующим материалом, который увеличивает толщину SEI-барьера, тем самым увеличивая сопротивление и потерю емкости; а HF вызывает хрупкость жесткой SEI-пленки, что приводит к диффузии карбонатного растворителя на материал катода, который в свою очередь выделяет тепло, что со временем может вызвать тепловой выброс. Также сообщалось о термической деградации электролитов, когда разложение растворителя и взаимодействие между солями лития и растворителями может происходить при температурах до 70°C. Кроме того, в результате реакций между органическими карбонатами могут образовываться продукты переэтерификации[2].
Экспериментальный
В данном исследовании было проведено несколько экспериментов с использованием ТГА, ДСК и анализа улетучивающегося газа для изучения стабильности 1,0 М LiPF6 в EC/DEC=50/50 (v/v), приобретенного у Sigma-Aldrich. Образцы готовили в перчаточном мешке, продуваемом аргоном, используя примерно 8 - 10 мг раствора электролита, пипеткой налитого в 40 мкл алюминиевые тигли, закрытые алюминиевыми крышками тиглей с прорезанным лазером отверстием диаметром 50 мкм для выхода газов. Перед испытанием образец электролита подвергался воздействию окружающей атмосферы (N2, O2, H2O,CO2 и т.д.) в течение разного количества времени.
Результаты и обсуждение
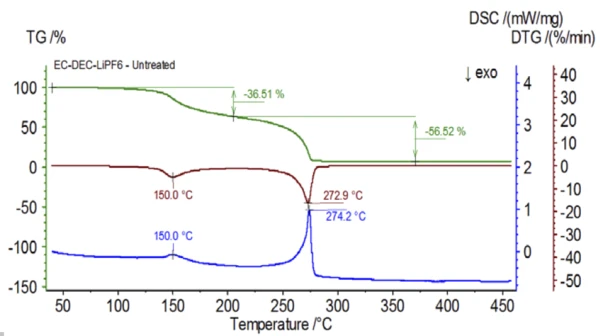
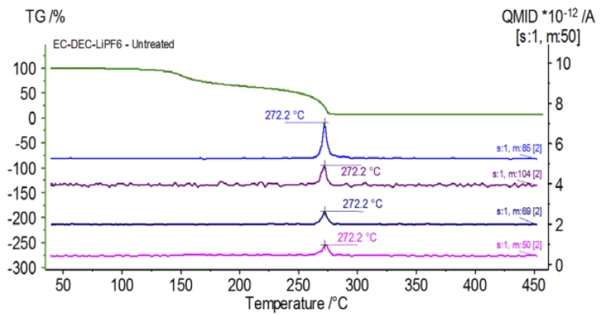
Исходный образец готовился в перчаточном мешке и сразу же загружался в NETZSCH STA 449 F1 Jupiter® , соединенный с QMS 403 Aëolos® (рис. 1), без воздействия окружающей атмосферы, чтобы приобрести свойства, присущие раствору электролита. Кривые ТГА, ДТГ и ДСК этого необработанного образца показаны на рис. 2. Образец продемонстрировал две ступени потери массы общим объемом 93,03 %, а также два эндотермических пика. Кроме того, пики в ДТГ (скорость изменения массы - %/мин) были обнаружены примерно при 150°C и 275°C.
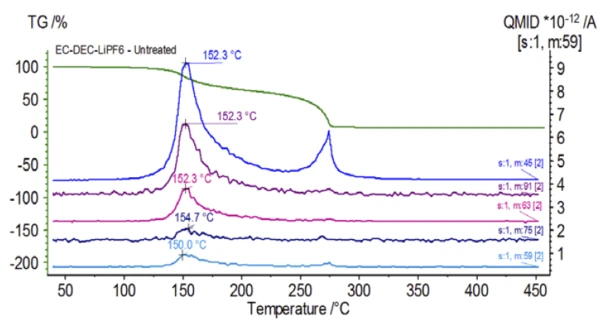
Масс-спектры этиленкарбоната и диэтилкарбоната из базы данных NIST library показаны на рисунке 3. Select массовые числа, соответствующие диэтилкарбонату, были прослежены (45, 59, 63, 75 и 91), как показано на рисунке 4, что указывает на то, чтопервым шагом потери массы было, скорее всего, испарение DEC.
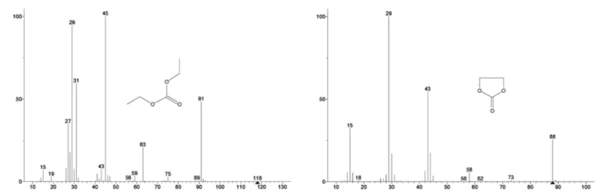
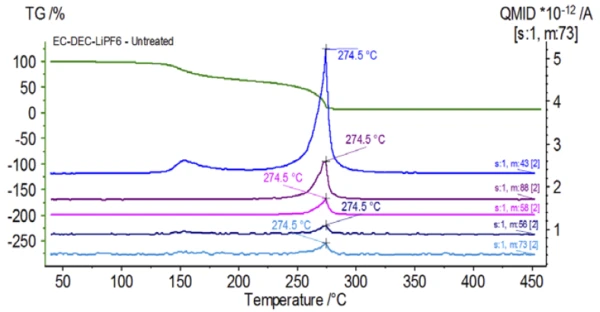
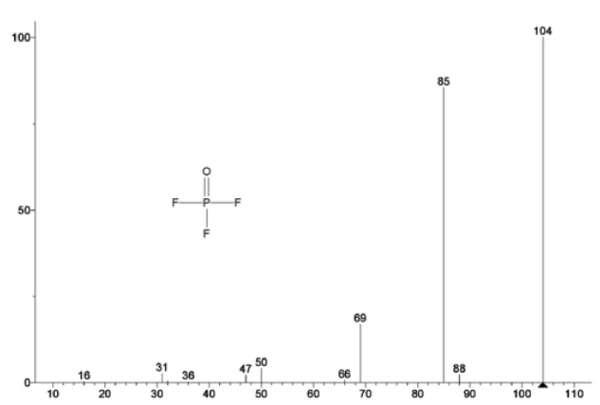
На рисунке 5 прослеживаются массовые числа, приписываемые этиленкарбонату (43, 56, 58, 73 и 88), что указывает на вероятное испарение EC во время2-й ступени потери массы. Кроме того, массовые числа 50, 69, 85 и 104, соответствующие POF3 (масс-спектр показан на рис. 6), также демонстрируют пики при 275°C (2-я ступень потери массы), показанные на рис. 7, что указывает на вероятное разложение LiPF6.
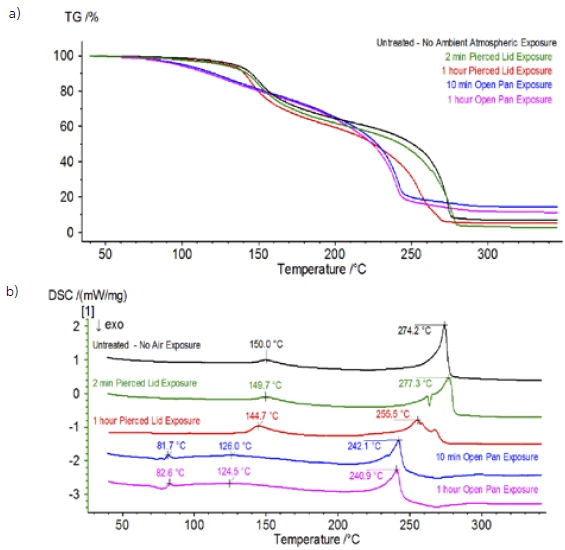
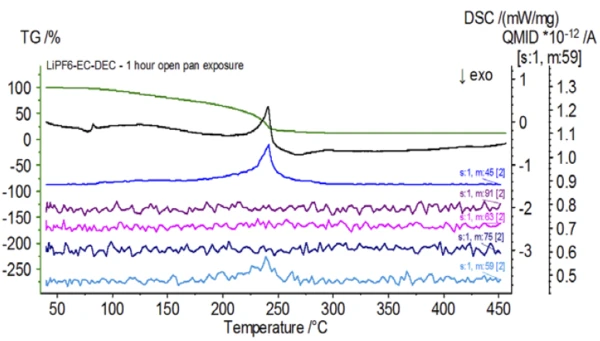
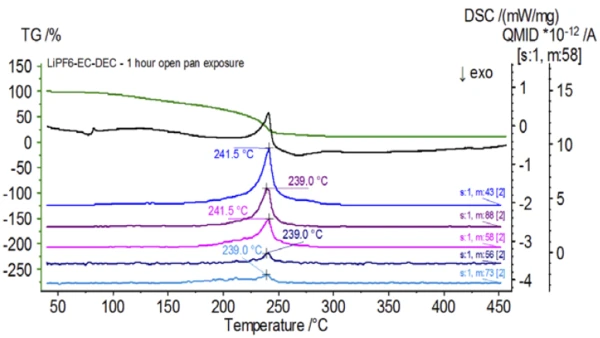
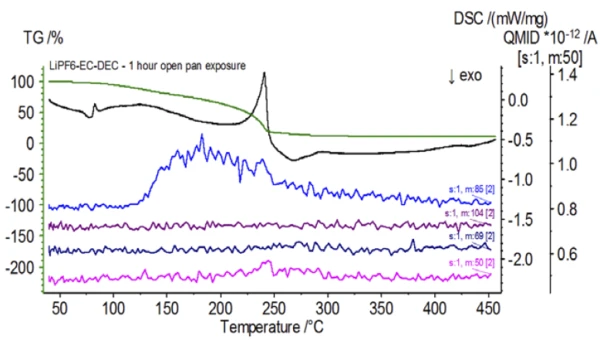
После завершения работы с необработанным образцом, который был подготовлен в инертных условиях, каждый последующий образец перед испытанием подвергался разной степени воздействия окружающей атмосферы. В первом эксперименте образец готовился в инертном перчаточном мешке с тиглем, закрытым проколотой крышкой, но перед испытанием образец подвергался воздействию окружающей атмосферы в течение 2 минут перед загрузкой для испытания. Вторая итерация имитировала первый эксперимент, но экспозиция составляла 1 час. В третьем эксперименте вместо того, чтобы обжимать тигель внутри перчаточного мешка, открытый алюминиевый поддон вынимался и полностью подвергался воздействию окружающей атмосферы в течение 10 минут, после чего на тигель надевалась крышка с проколом, а затем производилось обжимание. В заключительном эксперименте использовалась процедура третьего эксперимента, но время выдержки было увеличено до 1 часа. Результаты всех итераций, включая необработанный образец, показаны на рис. 8. Для образца, подвергнутого воздействию в течение 2 минут с проколотой крышкой, которая предназначена для минимизации утечки летучих веществ из образца, а также для ограничения проникновения окружающей атмосферы, кривые ТГА и ДСК показывают схожие профили с необработанным образцом; однако есть small, тонкие различия, такие как возможная двойная эндотермическая энергия на кривой ДСК наряду с небольшим сдвигом на2-й ступени потери массы на кривой ТГА, что может указывать на то, что испытуемый образец был скомпрометирован кратковременным воздействием окружающей атмосферы. При увеличении продолжительности атмосферного воздействия вовтором эксперименте образец, выдержанный в течение 1 часа, демонстрирует дальнейшие отклонения на кривой ТГА и более выраженный сдвиг на последней энергетической ступени ДСК. 10-минутное неограниченное воздействие из открытого тигля существенно изменило всю сложность электролита, так как появились дополнительные эндотермы ДСК, которых не было в необработанном образце, а последний эндотермический пик сместился к более низким температурам. ТГА также продемонстрировал испарение/разложение, начинающееся при более низких температурах, другой профиль потери массы и совершенно другие конечные количества потери массы (исходная масса образца была взята после истечения времени экспозиции образца). Образец, подвергшийся воздействию в течение 1 часа, также был подключен к СМК, где отслеживались те же массовые числа по сравнению с необработанным образцом. Массовые числа, относящиеся к диэтилкарбонату (45, 59, 63, 75 и 91), больше не проявляли активности в подвергнутом воздействию образце (Рисунок 9) по сравнению с необработанным образцом (Рисунок 4), что указывает на изменения состава, которые привели к образованию различных продуктов разложения. На рисунке 10 прослеживаются массовые числа, соответствующие этиленкарбонату (43, 56, 58, 73 и 88), что указывает на его вероятную эволюцию, но пик приходится на температуру примерно на 30°C ниже, чем в необработанном образце. Дальнейшие свидетельства композиционных изменений в образце, подвергшемся воздействию, можно увидеть, поскольку массовые числа, связанные с POF3 (50, 69, 85 и 104), больше не развиваются (рис. 11).
Резюме
Образцы, чувствительные к воздействию окружающей атмосферы, такие как электролиты, используемые в литий-ионных аккумуляторах, необходимо хранить и готовить с осторожностью. Даже минимальное воздействие может вызвать изменения в материале, приводящие к потенциально вредным и нежелательным последствиям, как это наблюдается при проведении ТГА, ДСК и анализа улетучивающихся газов.