Introduzione
Le batterie agli ioni di litio sono costituite da un catodo, un anodo, un separatore e un elettrolita. La funzione dell'elettrolita è quella di trasportare gli ioni di litio positivi tra il catodo e l'anodo attraverso il separatore. Gli elettroliti tradizionali sono costituiti da sali di litio e solventi organici aprotici. L'elettrolita più comunemente utilizzato è l'esafluorofosfato di litio (LiPF6) in una miscela di carbonati lineari e ciclici come il carbonato di etilene (EC: C3H4O3 - MM: 88,06 g*mol-1) e il dietilcarbonato (DEC: C5H10O3 - MM: 118,13 g*mol-1). La combinazione di LiPF6 e carbonati è utilizzata per l'elevata conducibilità e la capacità di formare un'interfaccia elettrolitica solida (SEI), necessaria per prevenire un'ulteriore Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione dell'elettrolita. Inoltre, può garantire la continuità delle reazioni elettrochimiche consentendo il trasporto degli ioni di litio e bloccando gli elettroni. Questi tipi di elettroliti sono estremamente sensibili ai fattori ambientali, motivo per cui il funzionamento di queste sostanze viene effettuato all'interno di una scatola a guanti in atmosfera inerte.

Reazione chimica
Uno di questi fattori dannosi che influiscono sulla stabilità dell'elettrolita è l'acqua. L'idrolisi del LiPF6 può avvenire in quantità pari ai livelli ppm diH2O, dando luogo alla seguente reazione chimica a più stadi: LiPF6 +H2O→ HF + PF5 + LiOH → LiF + 2HF + POF3.[1] I prodotti finali del LiF e dell'HF causano problemi nel sistema della batteria, in quanto il LiF è insolubile ed è un materiale elettronicamente isolante che aumenta lo spessore della barriera SEI, aumentando così l'impedenza e la perdita di capacità; mentre l'HF causa la fragilità della pellicola rigida SEI, con conseguente diffusione del solvente carbonato sul materiale del catodo che, a sua volta, rilascia calore che, nel tempo, potrebbe causare un runaway termico. È stata anche segnalata la degradazione termica degli elettroliti, dove la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del solvente e le interazioni tra i sali di litio e i solventi possono verificarsi a temperature fino a 70°C. Inoltre, dalle reazioni tra i carbonati organici possono formarsi anche prodotti di transesterificazione[2].
Sperimentale
In questo studio sono stati condotti diversi esperimenti tramite TGA, DSC e analisi dei gas evoluti per studiare la stabilità di 1,0 M LiPF6 in EC/DEC=50/50 (v/v) acquistato da Sigma-Aldrich. I campioni sono stati preparati in un sacchetto a guanti spurgato con argon, utilizzando circa 8-10 mg di soluzione elettrolitica pipettata in crogioli di alluminio da 40 μL, sigillati con coperchi di alluminio con un foro di 50 μm tagliato al laser per consentire lo sfiato dei gas. Il campione di elettrolita è stato esposto per un tempo variabile all'atmosfera ambientale (N2, O2,H2O,CO2, ecc.) prima del test.
Risultati e discussione
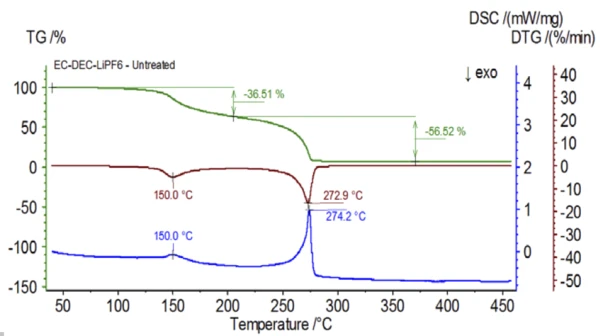
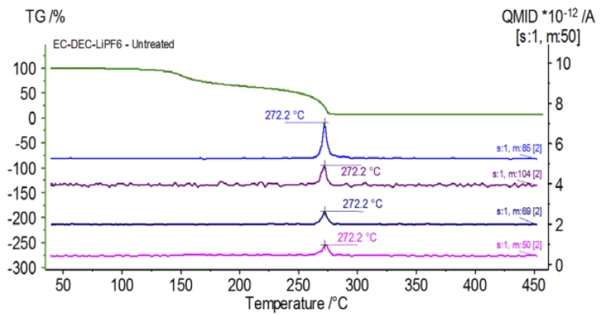
L'esperimento iniziale è stato preparato nel sacchetto a guanti e immediatamente caricato nel sistema NETZSCH STA 449 F1 Jupiter® accoppiato a un QMS 403 Aëolos® (Figura 1) senza esposizione all'atmosfera ambiente, al fine di acquisire le proprietà intrinseche della soluzione elettrolitica. Le curve TGA, DTG e DSC di questo campione non trattato sono mostrate nella Figura 2. Il campione ha mostrato due perdite di massa. Il campione ha mostrato due fasi di perdita di massa per un totale del 93,03% e due picchi endotermici. Inoltre, sono stati rilevati dei picchi nel DTG (tasso di variazione di massa - %/min) a circa 150°C e 275°C.
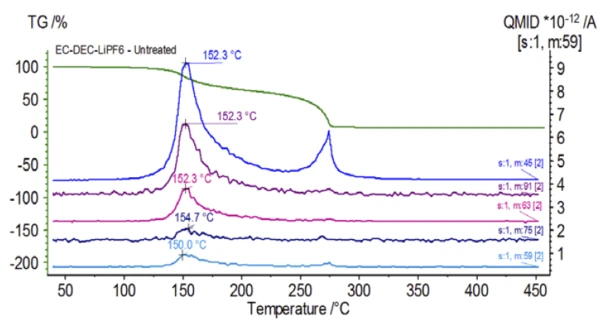
Lo spettro di massa del database NIST library del carbonato di etilene e del dietilcarbonato è mostrato nella Figura 3. Select numeri di massa corrispondenti al dietilcarbonato sono stati rintracciati (45, 59, 63, 75 e 91) come si vede nella Figura 4, indicando che laprima fase di perdita di massa è stata probabilmente l'evaporazione del DEC.
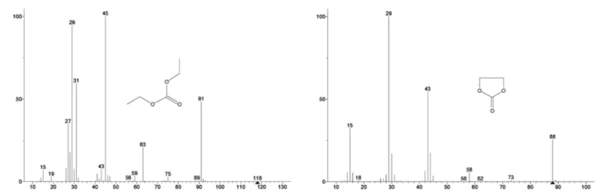
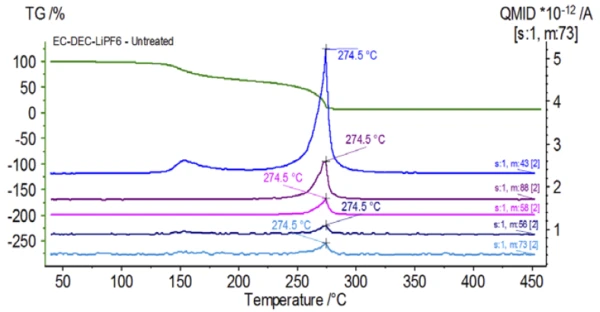
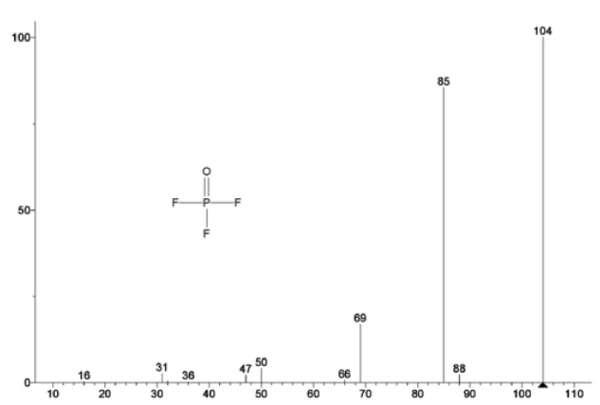
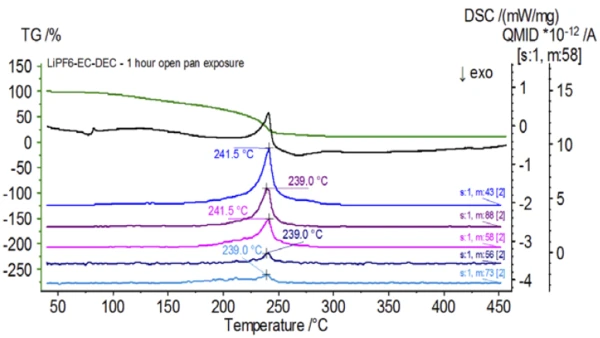
La Figura 5 traccia i numeri di massa attribuiti al carbonato di etilene (43, 56, 58, 73 e 88) che indicano una probabile evaporazione di EC durante laseconda fase di perdita di massa. Inoltre, i numeri di massa 50, 69, 85 e 104 corrispondenti al POF3 (spettro di massa visualizzato nella Figura 6) hanno mostrato anche picchi a 275°C (seconda fase di perdita di massa) mostrati nella Figura 7, indicando una probabile Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del LiPF6.
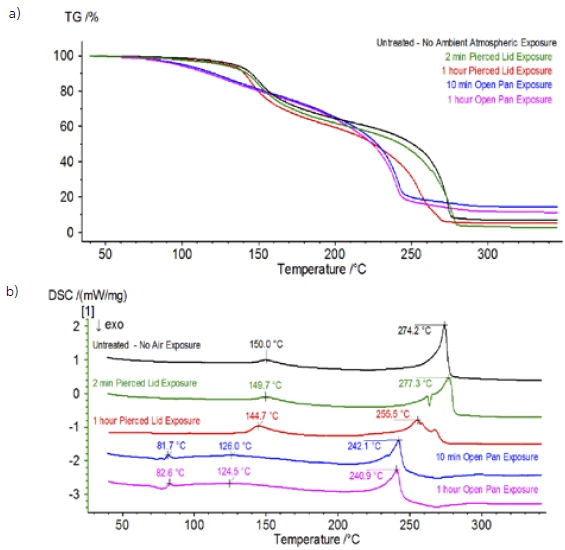
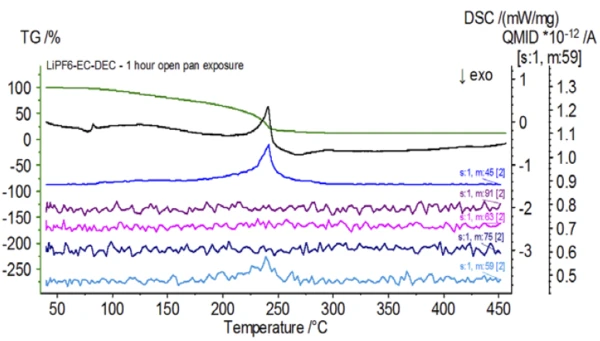
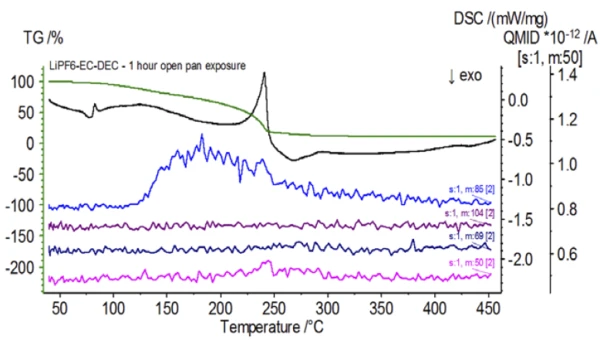
Al termine del campione non trattato, preparato in condizioni di inerzia, ogni campione successivo è stato sottoposto a diversi gradi di esposizione all'atmosfera ambiente prima di essere analizzato. Il primo esperimento ha preparato il campione nel sacchetto di guanti inerte con il crogiolo chiuso da un coperchio forato, ma prima del test il campione è stato esposto all'atmosfera ambiente per 2 minuti prima di essere caricato per il test. La seconda iterazione ha ricalcato il primo esperimento, ma l'esposizione è stata di 1 ora. Per il terzo esperimento, invece di chiudere il crogiolo all'interno del sacchetto a guanti, la vaschetta di alluminio aperta è stata rimossa e completamente esposta all'atmosfera ambiente per 10 minuti prima di posizionare il coperchio forato sul crogiolo e quindi di crimparlo. L'esperimento finale ha seguito la procedura del terzo esperimento, ma ha esteso il tempo di esposizione a 1 ora. I risultati per tutte le iterazioni, compreso il campione non trattato, sono mostrati nella Figura 8. Per il campione esposto per un periodo di 2 minuti con un coperchio forato, progettato per ridurre al minimo la fuoriuscita dei volatili del campione e per limitare l'ingresso dell'atmosfera ambiente, le curve TGA e DSC mostrano profili simili a quelli del campione non trattato; tuttavia ci sono small sottili differenze, come la possibile doppia energia endotermica nella curva DSC e un leggero spostamento delsecondo gradino di perdita di massa della curva TGA, che potrebbero indicare che il campione di prova è stato compromesso dalla breve esposizione all'atmosfera ambiente. Con l'aumento della durata dell'esposizione all'atmosfera nelsecondo esperimento, il campione di 1 ora mostra chiaramente ulteriori deviazioni nella curva TGA e presenta uno spostamento più pronunciato nell'ultima fase energetica DSC. Un'esposizione illimitata di 10 minuti da un crogiolo aperto ha essenzialmente cambiato l'intera complessità dell'elettrolita, poiché sono state osservate ulteriori endoterme DSC che non erano presenti nel campione non trattato, mentre l'ultimo picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico si è spostato a temperature più basse. Anche la TGA ha evidenziato un'evaporazione/Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione che inizia a temperature più basse, un diverso profilo di perdita di massa e quantità di perdita di massa finale completamente diverse (la massa iniziale del campione inserita è stata presa dopo l'esposizione del campione). Anche il campione completamente esposto per 1 ora è stato accoppiato al QMS, dove sono stati monitorati gli stessi numeri di massa rispetto al campione non trattato. I numeri di massa attribuiti al dietilcarbonato (45, 59, 63, 75 e 91) non hanno più mostrato attività nel campione esposto (Figura 9) rispetto al campione non trattato (Figura 4), indicando cambiamenti compositivi che hanno portato a prodotti di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione diversi. La Figura 10 traccia i numeri di massa corrispondenti al carbonato di etilene (43, 56, 58, 73 e 88) indicando la sua probabile evoluzione, ma con un picco di temperatura di circa 30°C inferiore rispetto al campione non trattato. Un'ulteriore prova dei cambiamenti compositivi nel campione esposto può essere vista come i numeri di massa associati al POF3 (50, 69, 85 e 104) non si evolvono più (Figura 11).
Sintesi
I campioni sensibili all'atmosfera ambientale, come gli elettroliti utilizzati nel settore delle batterie agli ioni di litio, devono essere conservati e preparati con cautela. Anche un'esposizione minima può iniziare a provocare cambiamenti nel materiale, causando potenziali effetti dannosi e indesiderati, come si è visto con le analisi TGA, DSC e dei gas evoluti.