Giriş
Lityum iyon piller bir katot, bir anot, bir ayırıcı ve bir elektrolitten oluşur. Elektrolitin işlevi, pozitif lityum iyonlarını katot ve anot arasında ayırıcı boyunca taşımaktır. Geleneksel elektrolitler lityum tuzu ve organik aprotik çözücülerden oluşur. En yaygın kullanılan elektrolit, etilen karbonat (EC: C3H4O3 - MM: 88,06 g*mol-1) ve dietil karbonat (DEC: C5H10O3 - MM: 118,13 g*mol-1) gibi doğrusal ve döngüsel karbonatların bir karışımındaki lityum hekzaflorofosfattır (LiPF6). LiPF6 ve karbonatların kombinasyonu, daha fazla elektrolit ayrışmasını önlemek için gerekli olan yüksek iletkenlik ve katı elektrolit arayüzü (SEI) oluşturma kabiliyeti nedeniyle kullanılır. Ayrıca elektronları bloke ederken lityum iyon taşınımının gerçekleşmesine izin vererek elektrokimyasal reaksiyonların devam etmesini sağlayabilir. Bu tür elektrolitler çevresel faktörlere karşı son derece hassastır, bu nedenle bu maddelerin çalışması inert atmosferli bir eldiven kutusu içinde gerçekleştirilir.

Kimyasal Reaksiyon
Elektrolitin kararlılığını etkileyen bu zararlı faktörlerden biri de sudur. LiPF6 'nın hidrolizi, aşağıdaki çok adımlı kimyasal reaksiyonla sonuçlananH2O'nun ppm seviyelerindeki miktarlarda meydana gelebilir: LiPF6 +H2O→ HF + PF5 + LiOH → LiF + 2HF + POF3.[1] LiF ve HF'nin son ürünleri batarya sisteminde sorunlara neden olur, çünkü LiF çözünmezdir ve SEI bariyerinin kalınlığını artırarak empedansı ve kapasite kaybını artıran elektronik olarak yalıtkan bir malzemedir; HF ise sert SEI filminin kırılgan hale gelmesine neden olarak karbonat çözücünün katot malzemesine yayılmasına yol açar ve bu da zamanla termal kaçağa neden olabilecek ısıyı açığa çıkarır. Elektrolitlerin termal bozunması da rapor edilmiştir; burada çözücü ayrışması ve lityum tuzları ile çözücüler arasındaki etkileşimler 70°C gibi düşük sıcaklıklarda meydana gelebilmektedir. Ayrıca organik karbonatlar arasındaki reaksiyonlardan transesterifikasyon ürünleri de oluşabilir[2].
Deneysel
Bu çalışmada, Sigma-Aldrich'ten alınan EC/DEC=50/50 (v/v) içindeki 1,0 M LiPF6 'nın kararlılığını araştırmak için TGA, DSC ve evrimleşmiş gaz analizi yoluyla çeşitli deneyler yapılmıştır. Numuneler argonla temizlenen bir eldiven torbasında, gazların çıkmasını sağlamak için lazerle kesilmiş 50 μm delikli alüminyum kroze kapaklarıyla kapatılmış 40 μL alüminyum krozelere pipetlenen yaklaşık 8-10 mg elektrolit çözeltisi kullanılarak hazırlanmıştır. Elektrolit numunesi, testten önce değişen sürelerde ortam atmosferine (N2,O2,H2O,CO2, vb.) maruz bırakılmıştır.
Sonuçlar ve Tartışma
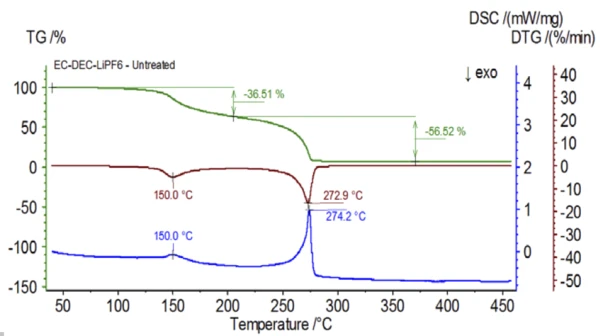
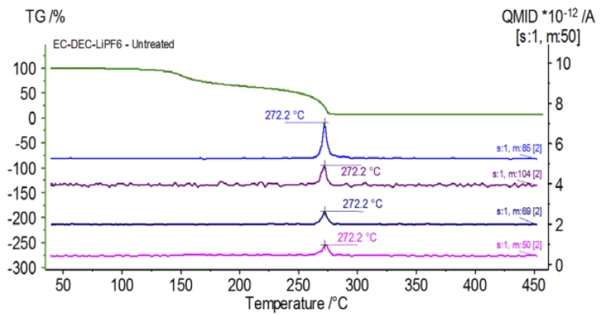
İlk deney eldiven torbasında hazırlanmış ve elektrolit çözeltisinin doğal özelliklerini elde etmek için ortam atmosferine maruz bırakılmadan hemen bir QMS 403 Aëolos® (Şekil 1) ile birleştirilmiş NETZSCH STA 449 F1 Jupiter® cihazına yüklenmiştir. Bu işlenmemiş numunenin TGA, DTG ve DSC eğrileri Şekil 2'de gösterilmektedir. Numune, iki EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik pikin yanı sıra toplamda %93,03'lük iki kütle kaybı adımı sergilemiştir. Ayrıca, DTG'de (kütle değişim oranı - %/dak) yaklaşık 150°C ve 275°C'de pikler tespit edilmiştir.
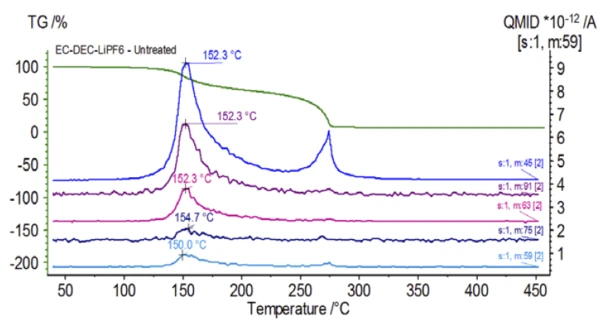
Etilen karbonat ve dietil karbonatın NIST library veritabanından alınan kütle spektrumu Şekil 3'te gösterilmiştir. Select dietil karbonata karşılık gelen kütle numaraları Şekil 4'te görüldüğü gibi izlenmiştir (45, 59, 63, 75 ve 91), bu da1. kütle kaybı adımının muhtemelen DEC'in buharlaşması olduğunu göstermektedir.
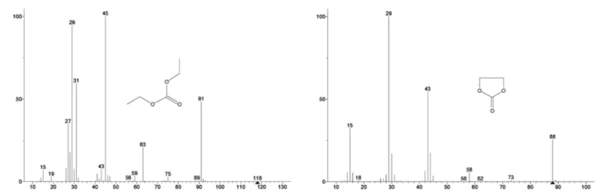
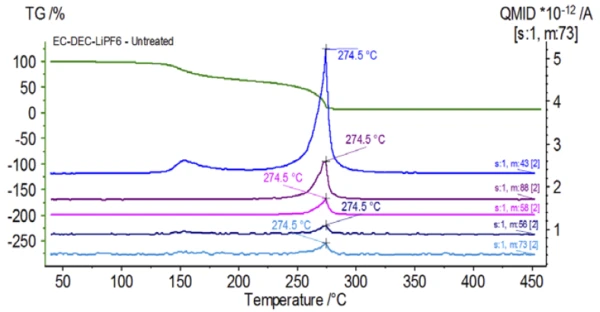
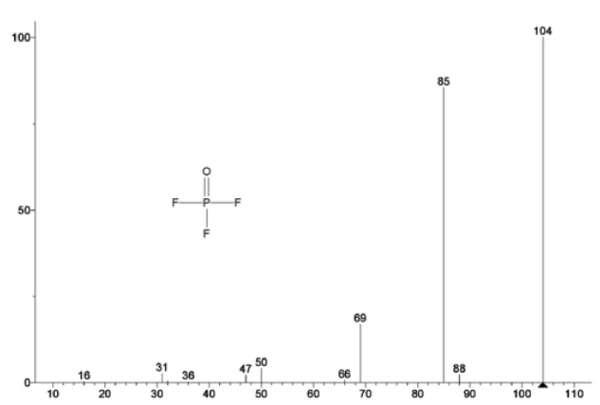
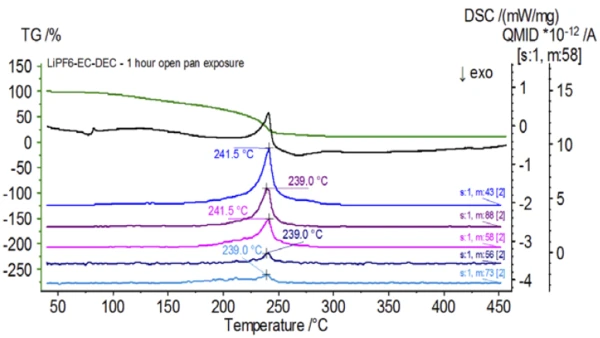
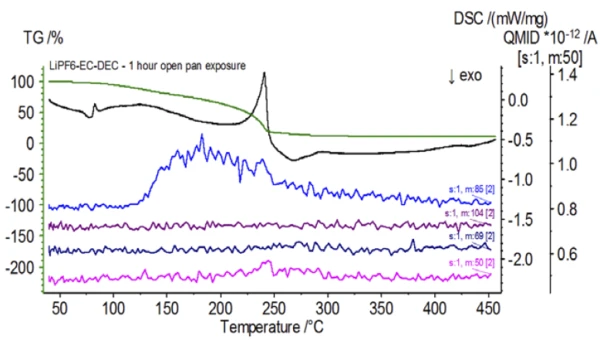
Şekil 5, etilen karbonata atfedilen kütle numaralarını (43, 56, 58, 73 ve 88) izler ve bu da2. kütle kaybı adımı sırasında EC'nin muhtemelen buharlaştığını gösterir. Ayrıca, PO'ya karşılık gelen 50, 69, 85 ve 104 kütle numaralarıF3 (Şekil 6'da gösterilen kütle spektrumu) da Şekil 7'de gösterilen 275°C'de (2. kütle kaybı adımı) LiPF6'nın muhtemel ayrışmasını gösteren pikler sergilemiştir.
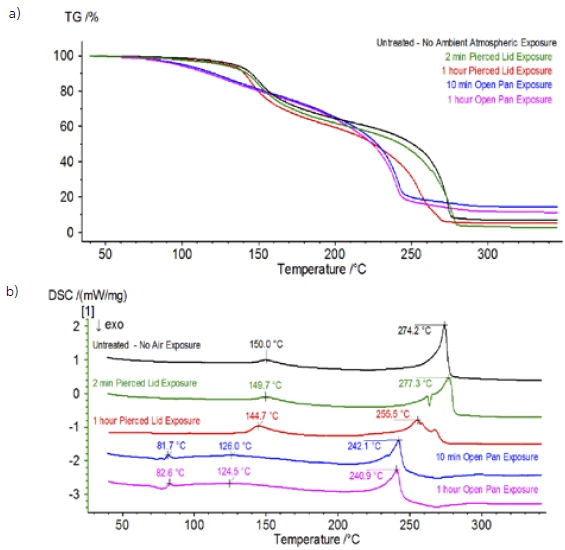
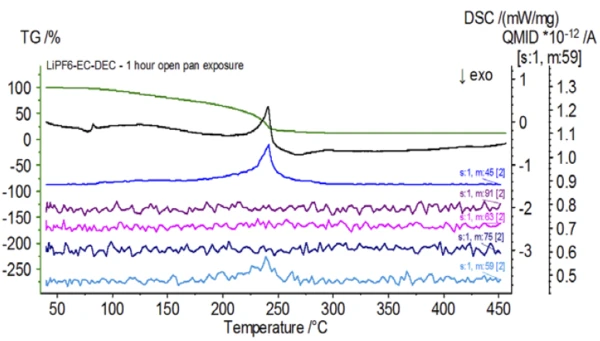
İnert koşullar altında hazırlanan işlem görmemiş numunenin tamamlanmasının ardından, birbirini takip eden her numune testten önce değişen derecelerde ortam atmosferine maruz bırakılmıştır. İlk deneyde numune inert eldiven torbasında, kroze delikli bir kapakla kapatılmış olarak hazırlandı, ancak testten önce numune test için yüklenmeden önce 2 dakika boyunca ortam atmosferine maruz bırakıldı. İkinci yineleme, 1 saat maruz bırakma dışında ilk deneyi taklit etmiştir. Üçüncü deneyde, krozeyi eldiven torbasının içinde sıkmak yerine, açık alüminyum tava çıkarılmış ve delinmiş kapak krozenin üzerine yerleştirilmeden ve ardından sıkılmadan önce 10 dakika boyunca ortam atmosferine tamamen maruz bırakılmıştır. Son deney üçüncü deneyin prosedürünü izlemiş ancak maruz kalma süresini 1 saate uzatmıştır. İşlem görmemiş numune de dahil olmak üzere tüm yinelemeler için sonuçlar Şekil 8'de gösterilmektedir. Numune uçucularının dışarı çıkmasını en aza indirmek ve ortam atmosferinin içeri girmesini sınırlamak için tasarlanan delinmiş bir kapakla 2 dakika süreyle maruz bırakılan numune için, TGA ve DSC eğrileri işlem görmemiş numune ile benzer profiller göstermektedir; ancak small, DSC eğrisindeki olası çift EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik enerji gibi ince farklılıkların yanı sıra TGA eğrisinin2. kütle kaybı adımında test numunesinin ortam atmosferine kısa süre maruz kalmasıyla tehlikeye girdiğini gösterebilecek hafif bir kayma vardır.İkinci deneyde atmosferik maruziyet süresinin artmasıyla, 1 saatlik numune TGA eğrisinde açıkça daha fazla sapma gösterir ve ikinci DSC enerjisinde daha belirgin bir kaymaya sahiptir. Açık bir potadan 10 dakikalık sınırsız maruz kalma, elektrolitin tüm karmaşıklığını esasen değiştirmiştir, çünkü işlem görmemiş numunede bulunmayan ek DSC endotermleri görülürken, ikinci EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik pik daha düşük sıcaklıklara kaymıştır. TGA ayrıca daha düşük sıcaklıklarda başlayan BuharlaşmaBir elementin veya bileşiğin buharlaşması, sıvı fazdan buhara bir faz geçişidir. İki tür buharlaşma vardır: buharlaşma ve kaynama.buharlaşma/Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma, farklı bir kütle kaybı profili ve tamamen farklı nihai kütle kaybı miktarları sergilemiştir (girilen ilk numune kütlesi, geçen numune maruziyetinden sonra alınmıştır). 1 saat boyunca tamamen maruz kalan numune de QMS'ye bağlanmış ve aynı kütle sayıları işlenmemiş numune ile karşılaştırılarak izlenmiştir. Dietil karbonata atfedilen kütle numaraları (45, 59, 63, 75 ve 91), işlem görmemiş numune (Şekil 4) ile karşılaştırıldığında maruz kalan numunede (Şekil 9) artık aktivite göstermemektedir ve bu da farklı bozunma ürünleri ile sonuçlanan bileşimsel değişiklikleri göstermektedir. Şekil 10'da etilen karbonata karşılık gelen kütle sayıları (43, 56, 58, 73 ve 88) muhtemel evrimini göstermektedir, ancak işlem görmemiş numuneden yaklaşık 30°C daha düşük bir sıcaklıkta zirve yapmaktadır. POF3 (50, 69, 85 ve 104) ile ilişkili kütle sayıları artık gelişmediğinden, maruz kalan numunedeki bileşimsel değişikliklerin daha fazla kanıtı görülebilir (Şekil 11).
Özet
Lityum İyon Pil endüstrisinde kullanılan elektrolitler gibi ortam atmosferine duyarlı numunelerin dikkatli bir şekilde saklanması ve hazırlanması gerekir. Minimum maruziyet bile malzemede değişikliklere neden olarak TGA, DSC ve evrimleşmiş gaz analizinde görüldüğü gibi potansiyel zararlı ve istenmeyen etkilere yol açabilir.