Wprowadzenie
W farmacji nie ma prawie żadnego aktywnego składnika, o którym napisano by więcej niż o kwasie acetylosalicylowym (lub w skrócie ASA; w krajach anglo- i niemieckojęzycznych nazwa marki Aspirin™ jest często używana nawet jako synonim). Historia jego sukcesu rozpoczęła się pod koniec XIX wieku, kiedy dr Felix Hoffmann po raz pierwszy zsyntetyzował tę substancję w laboratoriach BAYER bez zanieczyszczeń. Obecnie jest to nadal jeden z najpopularniejszych farmaceutyków, stosowany w szerokim zakresie terapeutycznym. Należy do grupy niesteroidowych leków przeciwzapalnych (NLPZ) i jest wskazany w leczeniu bólu, gorączki i stanów zapalnych. Ponadto jest stosowany w zapobieganiu nawrotom zawału serca lub udaru mózgu u pacjentów z grupy wysokiego ryzyka. W 1977 roku ASA został dodany jako lek przeciwbólowy do "listy podstawowych leków" WHO (Światowej Organizacji Zdrowia). [1]
Jest to ostatnia z czterech not aplikacyjnych, w których bardziej szczegółowo zbadano zachowanie termiczne kwasu acetylosalicylowego; pierwsze trzy dotyczyły rozkładu w różnych atmosferach gazowych, kinetyki rozkładu i powstających gatunków gazu [2, 3, 4].
Eksperymentalny
W celu zbadania rozkładu termicznego kwasu acetylosalicylowego przeprowadzono pomiary termograwimetryczne (TGA) za pomocą analizatora NETZSCH TG 209 Libra® w atmosferze helu. W celu wspomagania interpretacji, analizator termiczny został dodatkowo sprzężony z kwadrupolowym spektrometrem mas 403 Aëolos®. Dokładne warunki pomiaru zostały wyszczególnione w tabeli 1.
Tabela 1: Parametr pomiaru
| Parametr | Kwas acetylosalicylowy |
|---|---|
| Analizator | TG 209 Libra® z QMS 403 Aëolos® |
| Uchwyt próbki | TGA, typ S |
| Tygiel | Al2O3, 85 μl, otwarty |
| Masa próbki | 8.35 mg |
| Program temperaturowy | RT do 500°C, szybkość ogrzewania: 10 K/min |
| Atmosfera | Hel* (100 ml/min) |
*W tej pracy atmosfera helowa była zgodna z pomiarami zawartymi w poprzednich notach aplikacyjnych 208, 209 i 210 (część 1 do 3).
Wyniki pomiarów i dyskusja
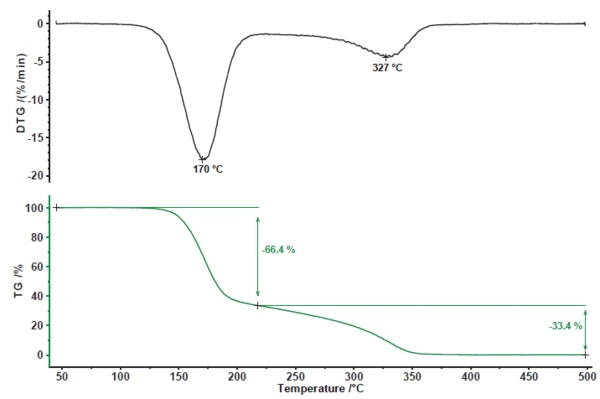
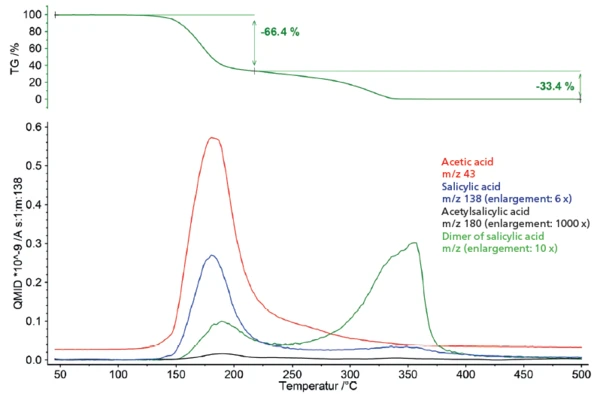
PirolizaPiroliza to termiczny rozkład związków organicznych w atmosferze obojętnej.Piroliza kwasu acetylosalicylowego wykazuje dwa etapy utraty masy (rysunek 1). Pierwszy etap utraty masy wynoszący 66,4% jest związany z pikiem w szybkości utraty masy (DTG) w temperaturze 170°C. Drugi etap utraty masy wynosi 33,4% z pikiem na krzywej DTG w temperaturze 327°C.
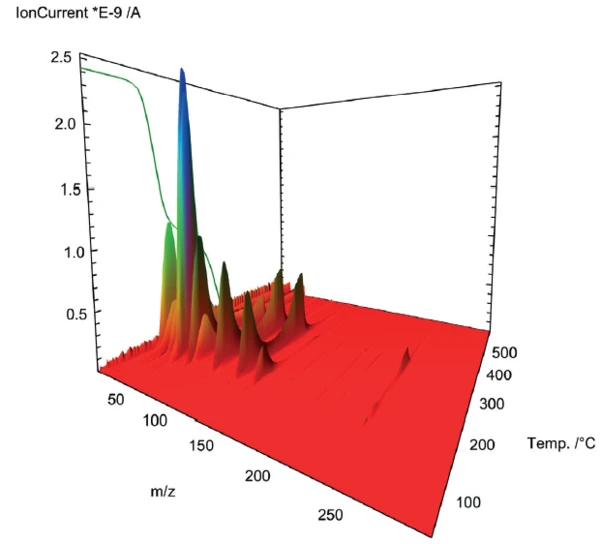
Sprzężenie spektrometru masowego wykorzystane do uzyskania głębszego wglądu w pirolizę kwasu acetylosalicylowego pokazuje złożony profil odgazowania w dwóch etapach utraty masy (rysunek 2). W celu dokładniejszego zbadania, widma masowe odpowiednich etapów zostały wyodrębnione i poddane porównaniu z bazą danych "NIST MS Library".
Analiza bazy danych pierwszego etapu utraty masy pokazuje głównie nakładające się uwalnianie kwasu acetylowego i salicylowego, co wskazuje na degradację funkcji acetylowej kwasu acetylosalicylowego (rysunek 3). Wraz z dwoma głównymi produktami odgazowania, w widmie reprezentowane są również wyższe liczby masowe (> 138 u), które można przypisać dimerowi kwasu salicylowego. Ponadto nie można wykluczyć częściowego odparowania nierozłożonego kwasu acetylosalicylowego w pierwszym etapie utraty masy, ponieważ wszystkie główne masy widma kwasu acetylosalicylowego (43, 60, 92, 120, 138 u) pokrywają się z wcześniej wspomnianymi produktami rozkładu.
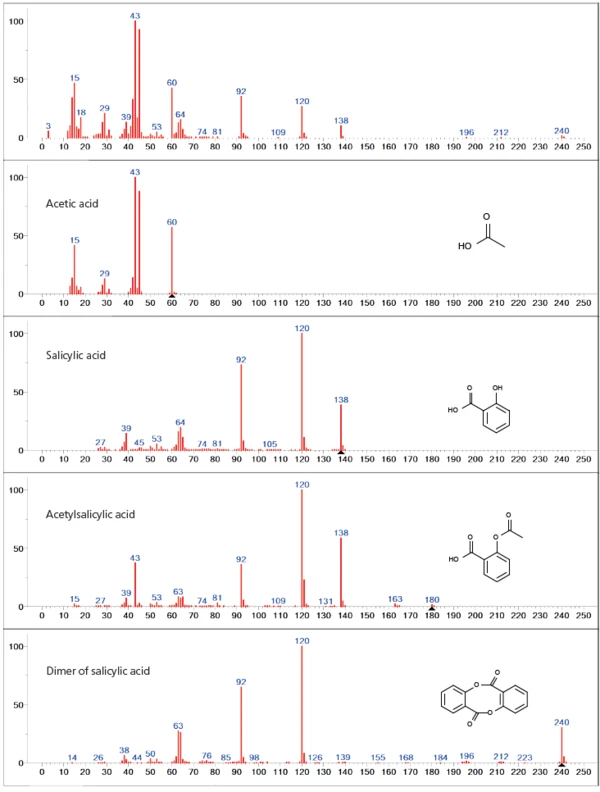
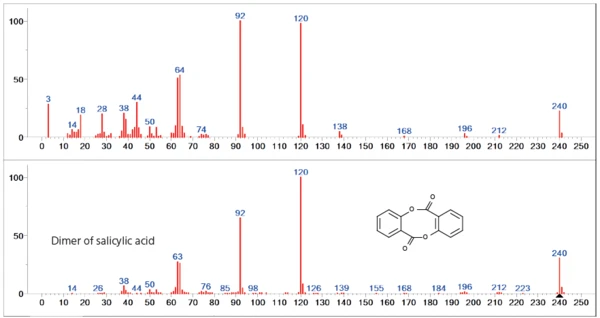
Drugi etap utraty masy jest zdominowany głównie przez uwolnienie dimeru kwasu salicylowego. Szczególnie w niższym zakresie mas (< 60u) można jednak zaobserwować różnice w stosunku do widma bazy danych, wskazujące na uwalnianie dodatkowych gatunków gazu (rysunek 4).
Ze względu na wykryte produkty odgazowania, można opracować zależny od temperatury obraz zachowania odgazowania. W tym celu określone liczby masowe poszczególnych produktów odgazowania zostały selected i wykreślone w porównaniu z krzywą ubytku masy (rysunek 5). Odpowiednia prezentacja ilustruje nakładanie się degradacji termicznej kwasu acetylosalicylowego i OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie kwasu salicylowego utworzonego jako produkt rozkładu w pierwszym etapie ubytku masy. Staje się również oczywiste, że tworzenie i odparowywanie oligomerów kwasu salicylowego rozpoczyna się już w tym samym zakresie temperatur i jest dominującym procesem degradacji w kolejnym przebiegu temperatury.
Podsumowanie
Połączenie termograwimetrii i spektrometrii mas jest potężnym narzędziem do uzyskiwania głębokiego wglądu w procesy rozkładu termicznego i uwalniane gazy. Połączenie ze spektrometrem mas pozwala na przegląd zależnych od temperatury produktów odgazowywania, który jest podobnie wysokiej jakości jak metoda łączenia termograwimetrii ze spektroskopią w podczerwieni. Jednak ze względu na bardziej specyficzny charakter widm masowych, połączenie ze spektrometrem masowym pozwala na wyciągnięcie bardziej precyzyjnych wniosków w odniesieniu do uwalnianych gatunków gazu.
Podsumowując, rozkład termiczny kwasu acetylosalicylowego w atmosferze helu zachodzi w dwuetapowym procesie składającym się z oddzielenia funkcji acetylowej i związanego z tym uwolnienia kwasu octowego wraz z odparowaniem kwasu salicylowego w postaci oligomeru (np. dimeru). Analiza gazowa odpowiednich etapów utraty masy wykazała częściowe nakładanie się tych dwóch procesów ze względu na jednoczesne uwalnianie kwasu octowego i salicylowego w pierwszym etapie utraty masy.
Szczegółowa analiza uzyskanych widm MS sugeruje, że nie wszystkie produkty odgazowania mogą być dostępne za pomocą bezpośredniego połączenia TGA ze spektrometrem mas. Tak więc, szczególnie w drugim etapie utraty, możliwe było jedynie wyraźne przypisanie części obserwowanych liczb masowych. Jednak połączenie chromatografii gazowej i spektrometrii mas (GC-MS), jak już pokazano w części 3 tej serii not aplikacyjnych, charakteryzuje się jeszcze bardziej wyspecjalizowaną metodologią sprzęgania, która została specjalnie opracowana do tego rodzaju zadań [4].