Einleitung
In der Pharmazie gibt es kaum einen Wirkstoff, über den mehr geschrieben wurde als über Acetylsalicylsäure (oder kurz ASS; im englischen und deutschen Sprachraum wird der Markenname Aspirin™ sogar oft als Synonym verwendet). Die Erfolgsgeschichte von Aspirin begann Ende des 19. Jahrhunderts, als Dr. Felix Hoffmann die Substanz in den BAYER-Laboren erstmals ohne Verunreinigungen synthetisierte. Bis heute ist es eines der beliebtesten Arzneimittel, das in einem breiten therapeutischen Spektrum eingesetzt wird. Es gehört zur Gruppe der nichtsteroidalen, entzündungshemmenden Antirheumatika (NSAIDs) und wird zur Behandlung von Schmerzen, Fieber und Entzündungen eingesetzt. Außerdem wird es zur Vorbeugung eines erneuten Herzinfarkts oder Schlaganfalls bei Risikopatienten angewandt. 1977 wurde ASS als Analgetikum in die “Liste der unentbehrlichen Arzneimittel“ der WHO (Weltgesundheitsorganisation) aufgenommen. [1]
Dies ist eines von vier Application Notes, die das thermische Verhalten von Acetylsalicylsäure näher untersuchen: Zersetzung in unterschiedlichen Gasatmosphären, Zersetzungskinetik und die entstehenden Gasspezies [2, 3, 4].
Experimenteller Teil
Zur Untersuchung der thermischen Zersetzung von Acetylsalicylsäure wurden thermogravimetrische Messungen (TG) unter Heliumatmosphäre* mit der NETZSCH TG 209 Libra® durchgeführt. Zur unterstützenden Interpretation wurde der Thermoanalysator zusätzlich mit einem Quadrupol-Massenspektrometer 403 Aëolos® gekoppelt. Eine detaillierte Zusammenstellung der genauen Messbedingungen kann der Tabelle 1 entnommen werden.
Tabelle 1: Messparameter
| Parameter | Acetylsalicylsäure |
|---|---|
| Analysegerät | TG 209 Libra® mit QMS 403 Aëolos® |
| Probenhalter | TG, Typ S |
| Tiegel | Al2O3, 85 μl, offen |
| Probeneinwaage | 8,35 mg |
| Temperaturprogramm | RT bis 500 °C, Heizrate: 10 K/min |
| Atmosphäre | Helium* (100 ml/min) |
*Hier wurde Heliumatmosphäre gewählt analog zu den vorangegangenen Application Notes, 208, 209 und 210 (Teil 1 bis 3) enthaltenen Messungen.
Messergebnisse und Diskussion
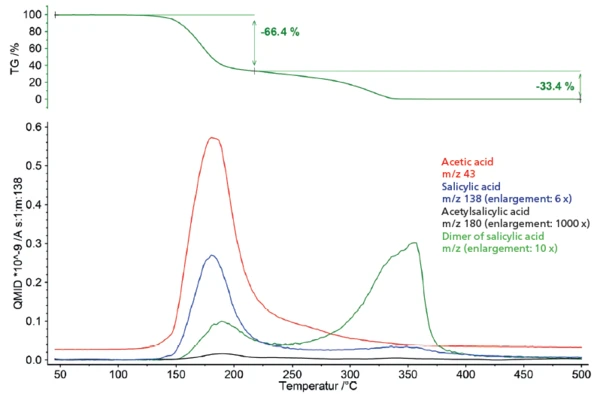
Die Pyrolyse von Acetylsalicylsäure weist zwei Massenverluststufen (Abbildung 1) auf. Der erste Massenverlust von 66,4 % ist mit einem Peak in der Massenverlustrate (DTG) bei 170 °C verbunden. Die zweite Massenverluststufe beträgt 33,4 % mit einem Peak in der DTG-Kurve bei 327 °C.
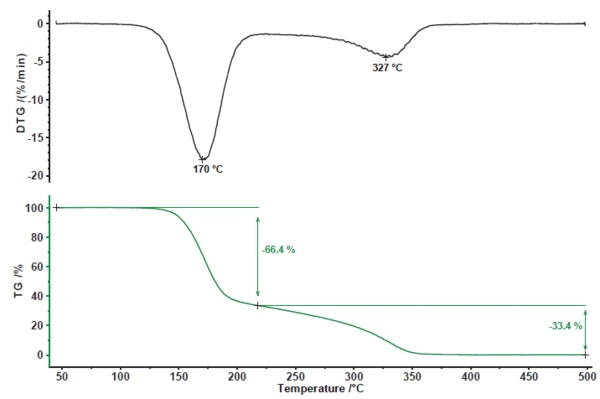
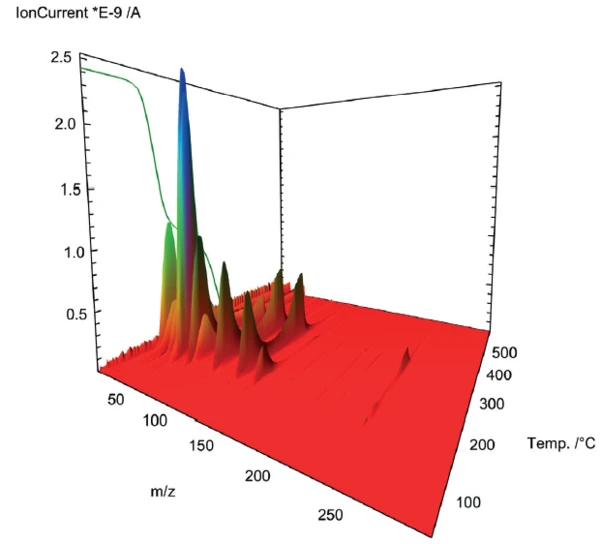
Die zum Aufbau eines tieferen Einblicks in die Pyrolyse von Acetylsalicylsäure verwendete Massenspektrometer-Kopplung zeigte ein komplexes Profil der Ausgasung für beide Verluststufen (Abbildung 2). Zur genaueren Betrachtung wurden die Massenspektren der jeweiligen Stufen extrahiert und einem Datenbankvergleich mit der „NIST MS Library“ unterzogen.
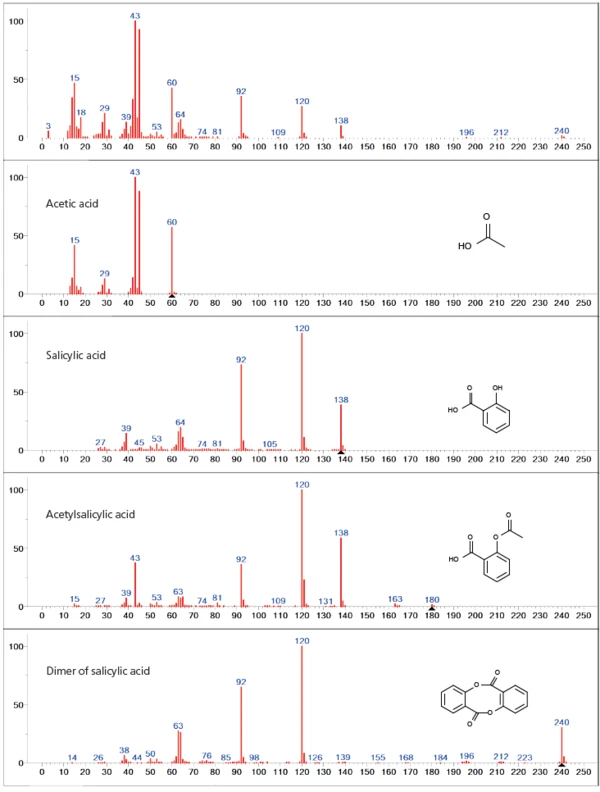
Die Datenbankanalyse der ersten Verluststufe zeigt maßgeblich eine überlagerte Freisetzung von Acetylsäure und Salicylsäure, was auf einen Abbau der Acetylfunktionalität der Acetylsalicylsäure hindeutet (Abbildung 3). Neben den beiden Hauptausgasungsprodukten sind auch höhere Massenzahlen (> 138 u) im Spektrum vertreten, welche dem Dimer der Salicylsäure zugeordnet werden können. Zusätzlich kann eine partielle VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung der unzersetzten Acetylsalicylsäure innerhalb der ersten Verluststufe nicht ausgeschlossen werden, da alle Hauptmassen des Acetylsalicylsäure-Spektrums (43, 60, 92, 120, 138 u) durch die zuvor genannten Abbauprodukte überlagert sind.
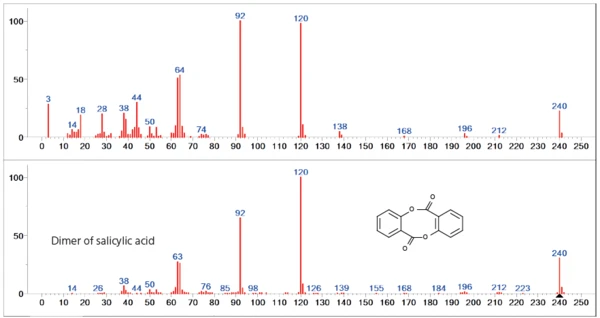
Die zweiten Verluststufe ist maßgeblich durch die Freisetzung des Dimers der Salicylsäure dominiert. Jedoch zeigen sich speziell im unteren Massenbereich (< 60 u) Unterschiede zum Datenbankspektrum, was auf eine Freisetzung weiterer Gasspezies hindeutet (Abbildung 4).
Anhand der gefundenen Ausgasungsprodukte kann eine temperaturabhängige Betrachtung des Ausgasungsverhalten erstellt werden. Hierfür werden jeweils spezifische Massenzahlen der einzelnen Ausgasungsprodukte ausgewählt und im Vergleich zur Massenverlustkurve aufgetragen (Abbildung 5). Die entsprechende Darstellung veranschaulicht die Überlagerung des thermischen Abbaus der Acetylsalicylsäure und die VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung der als Abbauprodukt gebildeten Salicylsäure im Rahmen der ersten Verluststufe. Ebenfalls wird deutlich, dass die Bildung und Verdampfung der Oligomere der Salicylsäure bereits im gleichen Temperaturbereich beginnt und im weiteren Temperaturverlauf den dominanten Abbauprozess darstellt.
Zusammenfassung
Die Kombination von Thermogravimetrie und Massenspektrometrie stellt eine leistungsfähige Kombination dar, um einen tiefen Einblick in thermische Zersetzungsprozesse und die dabei freigesetzten Gase zu erhalten. So ermöglicht die Kopplung mit einem Massenspektrometer einen ähnlich guten Überblick über die temperaturabhängigen Ausgasungsprozesse wie etwa die Kombination von Thermogravimetrie und Infrarotspektroskopie. Jedoch erlaubt die Kopplung mit einem Massenspektrometer aufgrund des spezifischeren Charakters der Massenspektren eine genauere Aussage bzgl. der freigesetzten Gasspezies.
Zusammenfassend erfolgt die thermische Zersetzung von Acetylsalicylsäure in Heliumatmosphäre in einem zweistufigen Prozess zusammengesetzt aus der Abspaltung der Acrylfunktionalität und damit verbundenen Freisetzung von Essigsäure sowie der Verdampfung der Salicylsäure in Oligomerform (z.B. Dimer). Die gasanalytische Betrachtung der jeweiligen Massenverluststufen belegte eine teilweise Überlagerung beider Prozesse aufgrund der gleichzeitigen Freisetzung von Essig- und Salicylsäure innerhalb der ersten Massenverluststufe.
Die genaue Analyse der erhaltenen MS-Spektren legt nahe, dass nicht alle Ausgasungskomponenten mittels direkter Kopplung an ein Massenspektrometer zur TGA zugänglich sind. Somit konnte speziell in der zweiten Verluststufe nur ein Teil der beobachteten Massenzahl eindeutig zugeordnet werden. Jedoch steht mit der Kombination aus Gaschromatographie und Massenspektrometrie (GCMS), wie bereits in Teil 3 dieser Applikationsreihe gezeigt wurde, eine noch spezialisiertere Kopplungsmethodik zur Verfügung, welche genau für diese Aufgabenstellung entwickelt wurde [4].