Einleitung
Zur Untersuchung von partikelgrößenabhängigen Eigenschaften und Eigenschaftsänderungen wurden kristalline Substanzen mit Hilfe von Mahlverfahren gezielt zerkleinert. Die Proben wurden anschließend mit verschiedenen Methoden der thermischen Analyse wie Thermogravimetrie (TG) [1], Differential Scanning Calorimetry (DSC) [2] und Dilatometrie [3] untersucht.
Es konnte gezeigt werden, dass selbst mit vergleichsweise geringer Variation der Partikelgröße signifikante Änderungen der thermischen Eigenschaften hervorgerufen werden. Dabei zeigen Reaktionen wie Entwässerungen oder Zersetzungen durch die zu Grunde liegenden Transportvorgänge ebenso Teilchengrößenabhängigkeiten wie das Schmelzen oder auch das SinternSintern ist ein Herstellungsverfahren zur Bildung eines mechanisch stabilen Körpers aus einem keramischen oder metallischen Pulver.Sintern. Die hier untersuchten thermischen Prozesse lassen sich in vier Kategorien einteilen:
- Schmelzen von Metallen (fest-flüssig)
- Reaktionen an der Partikeloberfläche (Verbrennung von Kohlenstoff)
- Freisetzung von gasförmigen Reaktionsprodukten (Entwässerung und Zersetzung)
- Sintern
Schmelzen
Die Variation der Partikelgröße im Größenbereich von Millimetern und Mikrometern weist nach Schmid [4] keinen nennenswerten Einfluss auf das Schmelzverhalten der Partikel auf. Bis zu einem Durchmesser oberhalb von 50 nm ist für sphärische Partikel der Anteil der an der Oberfläche beteiligten Partikel kleiner als 6 % und kann somit vernachlässigt werden. Für geringere Partikelgrößen (r < 25 nm) steigt der Anteil der oberflächennahen – und damit koordinativ unvollständig abgesättigten – Partikel an und führt nach dem Modell von Reifenberger [5] zu einer signifikanten Absenkung der Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelztemperatur [6].
Reaktionen an der Partikeloberfläche
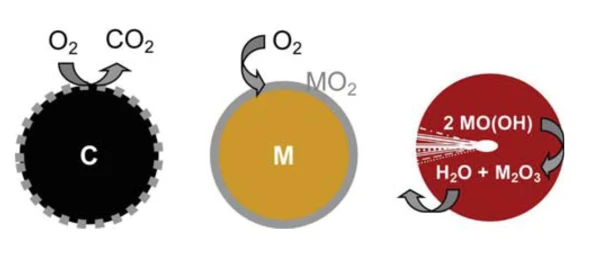
Die Verbrennung von Kohlenstoffpartikeln kann als Modell einer Oberflächenreaktion herangezogen werden. Der gasförmige Reaktand Sauerstoff kann gleichmäßig der Partikeloberfläche zugeführt werden und reagiert dort zu einem gasförmigen und damit leicht wieder abzuführenden Produkt CO2. Damit wird durch die Reaktion selbst kontinuierlich eine frische, reaktive Oberfläche gebildet. Das ursprüngliche Partikel wird in seiner Größe reduziert, bis ein vollständiger Umsatz erreicht ist. Im Gegensatz dazu stellt bei der OxidationOxidation kann im Zusammenhang mit thermischer Analyse verschiedene Vorgänge bezeichnen.Oxidation von Metallen die Produktschicht in der Regel eine passivierende Sperrschicht dar, die ab einer gewissen Stärke den Zutritt des Sauerstoffs zum metallischen Kern behindert und damit den quantitativen Umsatz erschwert (Abbildung 1).
Messergebnisse
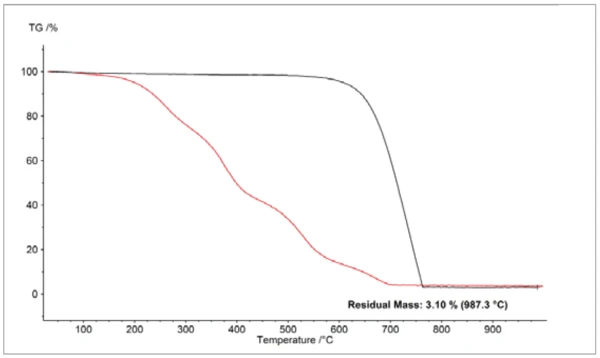
Die Reaktion verschiedener RußTemperatur und Atmosphäre (Spülgas) beeinflussen die Ergebnisse der Massenänderung. Durch Änderung des Atmosphärenspülgases von Stickstoff auf synthetische Luft während der TG-Messung werden die Auftrennung und Quantifizierung von Additiven, z.B. Ruß, und des Bulk-Polymers realisiert.Rußtypen mit Sauerstoff zeigt, dass selbst für das Modellsystem Kohlenstoff ein sehr unterschiedliches Verbrennungsverhalten bei vergleichbaren Partikelgrößen (~50 nm) beobachtet werden kann (Abbildung 2). Die Unterschiede sind hier auf sehr unterschiedliche Porositäten und damit auf die spezifische Oberfl äche zurückzuführen. Dies belegt, dass die Partikelgröße selbst nur ein grobes Maß für die Beurteilung des Oxidationsverhaltens ist.
Freisetzung von gasförmigen Reaktionsprodukten
Im Gegensatz zu einer Fest–Gas-Reaktion muss bei Zersetzungsreaktionen kein Reaktand zugeführt werden. Die Reaktion wird aber in der Regel von Transportvorgängen maßgeblich beeinflusst. Obwohl die Oberfläche als solche hier nicht ausschlaggebend ist, wird über die Partikelgröße die Länge des Transportweges vorgegeben. Freigesetzte Gase müssen über offene Porosität oder Kanäle an die Oberfläche des Partikels transportiert werden. Für sehr kleine Partikel wird dieser Vorgang erheblich vereinfacht.
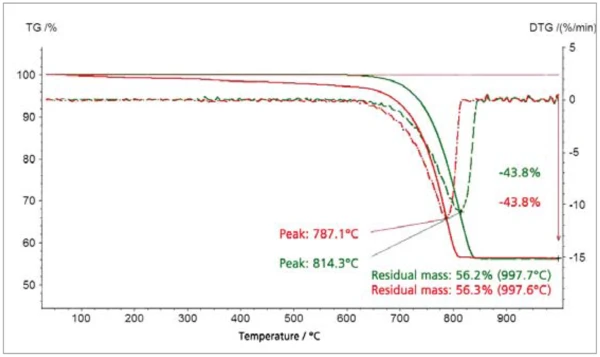
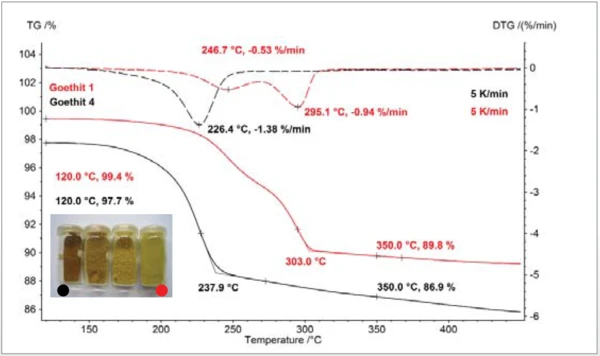
Die Beispiele CaCO3 (Abbildung 3) und Goethit (Abbildung 4) belegen die deutliche Verschiebung der Freisetzungsreaktion von CO2 bzw. H2O zu niedrigeren Temperaturen für geringere Partikelgrößen [6]. Die thermogravimetrischen Resultate quantifizieren die freigesetzten Gasmengen und belegen somit, dass die Stöchiometrie über die Variation der Partikelgröße unverändert bleibt.
Im Falle der Dehydratation von a-FeOOH (Goethit) zu a-Fe2O3 (Hämatit) konnte mit Hilfe von thermokinetischen Analysen gezeigt werden, dass der Reaktionsverlauf für kleinere Partikel mit einem einfacheren formalkinetischen Model angepasst werden kann als dies für größere Partikel der Fall ist. Aus Messdaten mit verschiedenen Heizraten konnte die Aktivierungsenergie für die kleinsten Partikel in einer zweistufigen Folgereaktion n-ter Ordnung mit 150 kJ/mol berechnet werden [7]. Die Massenverluststufen weisen für alle Messungen Werte auf, die der Stöchiometrie der Umsetzung von Goethit zu Hämatit entsprechen. Die Reaktionstemperatur und ReaktionsenthalpieReaktionstemperatur und Reaktionsenthalpie können mit z.B. mit Hilfe der dynamischen Differenz Thermoanalyse (DSC) bestimmt werden. Das Verfahren dazu ist z.B. in der DIN EN ISO 11357-5 beschrieben.Reaktionstemperatur verschiebt sich ebenso wie beim CaCO3 mit kleinerer Partikelgröße zu niedrigeren Werten. Das Foto in Abbildung 4 zeigt die Veränderung der optischen Wahrnehmung der Goethitproben mit variierender Teilchengröße.
Sintern
Die teilchengrößenabhängigen Effekte beim Sintern von Pulverpresslingen lassen sich alleine mit der Oberflächenvergrößerung nicht erklären (Abbildung 5). Denn im Gegensatz zum Schmelzverhalten sind Partikelgrößeneffekte bereits im Mikrometerbereich detektierbar und führen bereits bei relativ geringer Varianz der Partikelgröße zu einer signifikanten Reduktion der Sintertemperatur.
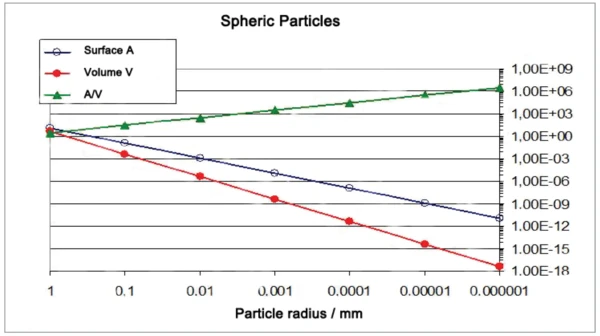
Die Anzahl der Kontaktpunkte zwischen sphärischen Partikeln nimmt beim Verringern der Partikelgröße sehr viel stärker zu, als das Verhältnis von Oberfläche zu Volumen (Abbildungen 6 und 7). Für die Zunahme der Sinteraktivität sind die Kontaktpunkte zwischen Partikeln maßgebend. Durch die Vermahlung mit der Rührwerkskugelmühle NETZSCH ZETA® RS4 wurden die mittleren Partikelgrößen im Bereich zwischen 10 μm und 130 nm variiert.
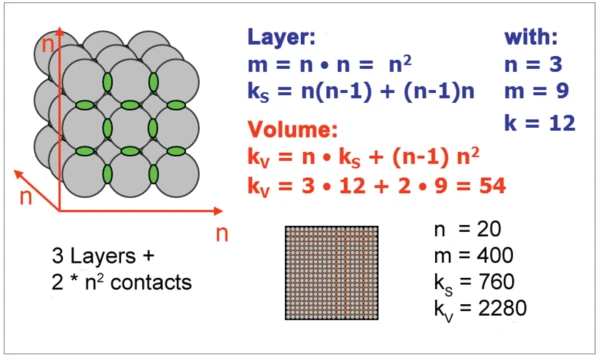
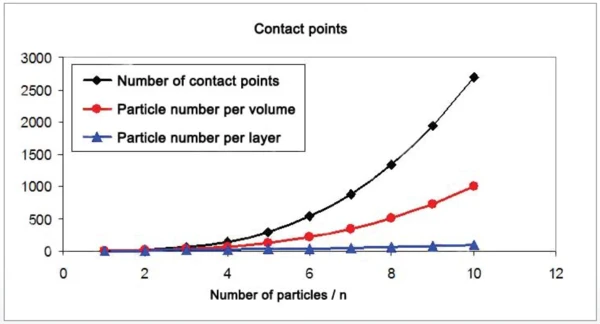
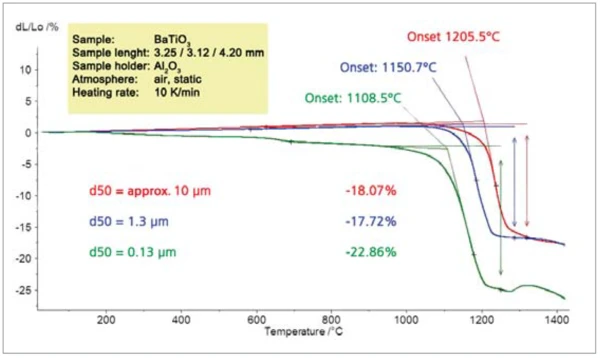
Abbildung 8 zeigt die Zunahme der Sinteraktivität für geringere Partikelgrößen am Beispiel von BaTiO3. Die Sintertemperatur liegt für die kleinsten Partikel mit 1108 °C (extrapolierte Onset-Temperatur) um 100 K niedriger als die Sintertemperatur der größeren Partikel (10 μm; 1205 °C).
Zusammenfassung
Für die verschiedenen Reaktionstypen wie Dehydratation, Zersetzung, Verbrennung und das Sintern konnte mit Hilfe von thermoanalytischen Messungen gezeigt werden, dass die Partikelgröße von pulverförmigen Proben einen signifikanten Einfluss auf die Messergebnisse hat. Die Probenpräparation, und hier speziell die Partikelgröße, ist somit ein wichtiger Parameter, der für die Interpretation von Messergebnissen nach Möglichkeit Berücksichtigung finden sollte.
Andererseits können die Methoden der thermischen Analyse zwar weder Partikelgrößen bestimmen noch Partikel abbilden, aber sobald eine Variation der Partikelgröße vorliegt, ändern sich auch die thermischen Kenngrößen der Proben und dann stehen mit der thermischen Analyse vergleichsweise schnelle und einfache Untersuchungsmethoden zur Verfügung, um die Änderungen der Probeneigenschaften zu ermitteln.