Einleitung
In der Pharmazie gibt es kaum einen Wirkstoff, über den mehr geschrieben wurde als über Acetysalicylsäure (oder kurz ASS; im englischsprachigen Raum wird der Markenname Aspirin™ sogar oft als Synonym verwendet). Die Erfolgsgeschichte von Aspirin begann Ende des 19. Jahrhunderts, als Dr. Felix Hoffmann die Substanz in den BAYER-Laboren erstmals ohne Verunreinigungen synthetisierte. Bis heute ist es eines der beliebtesten Arzneimittel, das in einem breiten therapeutischen Spektrum eingesetzt wird. Es gehört zur Gruppe der nichtsteroidalen, entzündungshemmenden Antirheumatika (NSAIDs) und wird zur Behandlung von Schmerzen, Fieber und Entzündungen eingesetzt. Außerdem wird es zur Vorbeugung eines erneuten Herzinfarkts oder Schlaganfalls bei Risikopatienten angewandt. 1977 wurde ASS als Analgetikum in die “Liste der unentbehrlichen Arzneimittel“ der WHO (Weltgesundheitsorganisation) aufgenommen [1].
Dies ist das zweite von vier Application Notes, die das thermische Verhalten von Acetylsalicylsäure näher untersuchen. Die weiteren Application Notes beschäftigen sich mit dem thermischen Verhalten in unterschiedlichen Gasatmosphären und den bei der Pyrolyse gebildeten Gasspezies [2][3][4].
Kinetische Analyse thermoanalytischer Daten
Mit den Messdaten thermoanalytischer Methoden erhält man im Rahmen der Auswertung unmittelbar Informationen über den Massenverlust, aufgrund von Zersetzung, Pyrolyse oder Verbrennung, die energetischen Änderungen, wie Schmelzen und Kristallisieren, oder auch Änderungen der Probendimension durch thermische Ausdehnung oder das SinternSintern ist ein Herstellungsverfahren zur Bildung eines mechanisch stabilen Körpers aus einem keramischen oder metallischen Pulver.Sintern etwa bei keramischen Materialien. Mit diesen Aussagen ist jedoch der Informationsgehalt der thermischen Analysemethoden nicht erschöpfend genutzt. Mit Hilfe einer weitergehenden kinetischen Analyse lassen sich darüber hinaus Informationen über den zeitlichen Verlauf einer Reaktion bei unterschiedlichen Temperaturen also die Reaktionsgeschwindigkeit gewinnen. Gelingt es, den Verlauf einer Reaktion mit Hilfe eines Systems aus mathematischen Gleichungen ausreichend gut zu beschreiben, dann sind Vorhersagen über den Reaktionsverlauf möglich, die experimentell nicht oder nur schwer zugänglich sind. Damit wiederum kann es gelingen Prozesse zu optimieren, oder die Lebensdauer, die Oxidationsstabilität oder das Alterungsverhalten von Materialien und Produkten vorherzusagen.
Ergebnisse und Diskussion
Um das thermische Verhalten von Acetylsalicylsäure besser zu verstehen, wurde ein kinetischer Ansatz verfolgt und versucht, ein System von mathematischen Gleichungen zur Beschreibung der experimentellen Daten zu finden. Das thermische Verhalten wurde mit einer NETZSCH-TG 209 F1 Libra® mit den in Tabelle 1 zusammengefassten Messbedingungen untersucht. Ein kinetischer Ansatz erfordert eine Serie von mindestens drei Heizraten, um die Zeit-Temperaturkorrelation zu beschreiben, was im Allgemeinen Hauptziel kinetischer Auswertungen ist.
Tabelle 1: TG-Messparameter
| Parameter | Acetylsalicylsäure |
|---|---|
| Probeneinwaage [mg] | 4,982 │ 5,014 │ 5,053 |
| Atmosphäre | Argon |
| Tiegel | Al2O3, 85 μl, offen |
| Temperaturprogramm | RT - 450°C |
| Heizraten [K/min] | 3 │ 10 │ 30 |
| Gasflussrate [ml/min] | 40 |
| Probenhalter | TG |
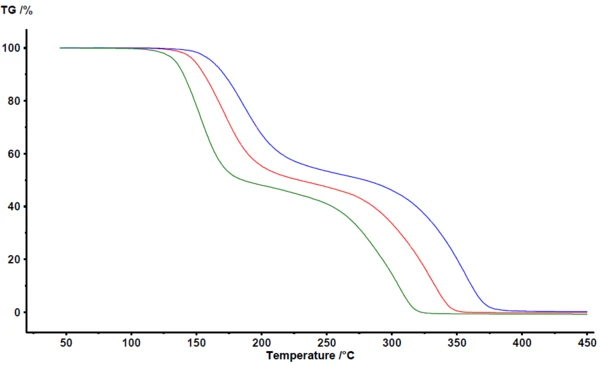
Abbildung 1 zeigt die in der NETZSCH-Proteus®-Analysesoftware erhaltenen Ergebnisse. Zwischen 100 °C und 400 °C wurden mittels Thermogravimetrie zwei Hauptmassenverluststufen während der Pyrolyse von Acetylsalicylsäure detektiert. Die TG-Kurven werden mit zunehmender Heizrate zu höheren Temperaturen verschoben. Die weitgehend parallele Verschiebung sowie die nahezu identische Endmasse deuten darauf hin, dass die Heizrate selbst den Reaktionsmechanismus nicht wesentlich verändert – ein deutlicher Hinweis auf einen nicht sehr komplexen Reaktionsmechanismus. Weiterhin ist zu erkennen, dass die Massenverluststufen nicht perfekt voneinander getrennt sind. Es ist kein Plateau ersichtlich, das das Ende der ersten Massenverluststufe oder den Beginn der zweiten Massenverluststufe eindeutig definiert. Wie mittels Kopplungstechniken wie TG-FT-IR, TG-MS oder TG-GC-MS bestätig werden konnte, findet neben der Pyrolyse gleichzeitig auch ein Verdampfen statt [2][4][5].
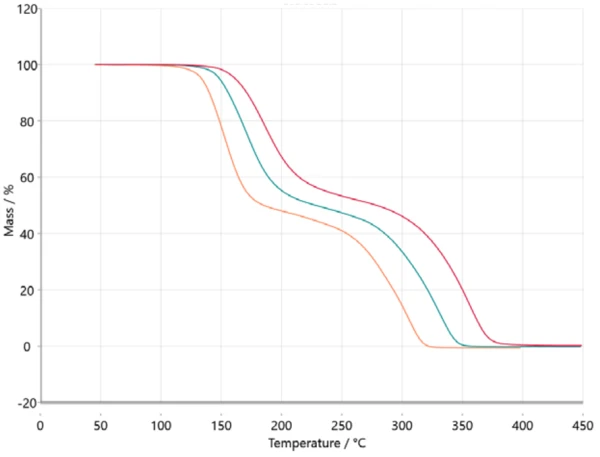
Für die kinetische Analyse werden die Messdaten über ASCII in die NETZSCH-Kinetics Neo-Software überführt. Die importierten Daten sind in Abbildung 2 dargestellt.
Um einen ersten Eindruck über den Reaktionsmechanismus zu bekommen, ist es sinnvoll, die kinetische Analyse mit sogenannten modellfreien Ansätzen zu beginnen. Abbildung 3 zeigt die Ergebnisse nach Ozawa-Flynn-Wall, wobei der Logarithmus der Heizrate gegen die inverse Temperatur aufgetragen wird. Dieser Ansatz geht über den üblichen Ansatz nach Arrhenius hinaus, denn er berücksichtigt nicht nur alle gemessenen Datenpunkte, sondern liefert auch Informationen über die Änderung der Aktivierungsenergie sowie den Präexponentialfaktor über den gesamten Reaktionsverlauf (Umsatzgrad). Dies ist besonders bei mehrstufigen Reaktionen hilfreich. Der Plot beschreibt den Reaktionsverlauf (von rechts nach links) für alle drei Heizraten (horizontale Symbole). Die vertikal verlaufenden Linien verbinden für jede Heizrate den gleichen Umsatzgrad und werden daher als Isokonversionslinien bezeichnet.
Diese Isokonversionslinien sind im Bereich für die beiden Hauptpyrolyseschritte am Anfang und am Ende des gesamten Vorgangs mehr oder weniger parallel. Bei einem Umsatz von ca. 50 % zeigen die Isokonversionslinien eine andere Steigung, die auf eine Änderung des Reaktionsmechanismus hinweist. In diesem Reaktionsstadium finden, wie bereits erwähnt, Pyrolyse und VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung gleichzeitig statt [2][4][5].
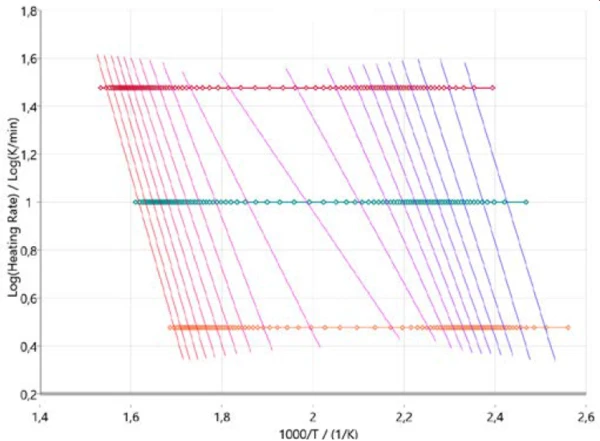
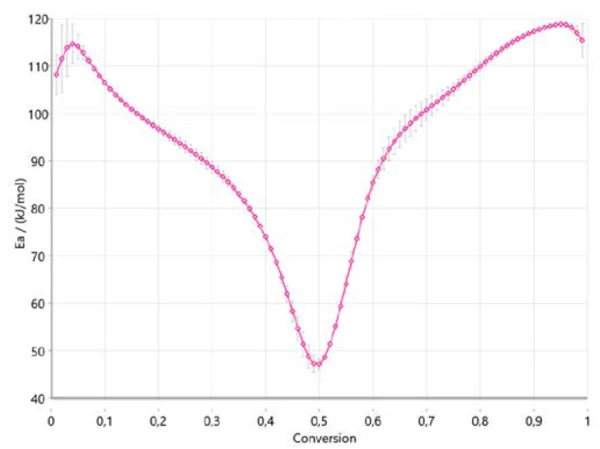
Abbildung 4 zeigt, wie sich die Aktivierungsenergie nach Ozawa-Flynn-Wall mit dem Verlauft des Umsatzes ändert. Dies ist eine sehr wichtige Information, da sie bereits drei Bereiche für den gesamten Prozess anzeigt mit einer Aktivierungsenergie von ca. 110 kJ/mol am Anfang, von ca. 40 kJ/mol zwischen 40 % und 50 % Konversion und eine Aktivierungsenergie von ca. 120 kJ/mol am Ende der Reaktion. Die Änderung der Aktivierungsenergie mit dem Umsatzgrad bestätigt einen mehrstufigen Reaktionsmechanismus. Die erhaltenen Werte stimmen gut mit den in der Literatur veröffentlichten Ergebnissen überein [6].
Überträgt man diese Information in eine modellbasierte Analyse, erhält man ein dreistufiges Folgemodell (t:FnFnFn), wobei A das Ausgangsmaterial (Acetylsalicylsäure), B und C die aus der Literatur bekannten Zwischenprodukte [6, 7] und D das Endprodukt darstellen. In diesem Fall ist das Endprodukt natürlich keine wirkliche Substanz, beschreibt jedoch das Reaktionsende bzw. den 100%-igen Umsatz, da die Restmasse für alle drei thermogravimetrischen Kurven gleich Null ist. Alle freigesetzten Produkte sind gasförmig und somit befindet sich nach Erreichen der Endtemperatur keine Substanz mehr im Probentiegel. Abbildung 5 zeigt das Ergebnis dieses modellbasieren Ansatzes. Die Messdaten sind als Symbole und die Ergebnisse für das berechnete dreistufige Folgemodell als durchgezogene Linien dargestellt, wobei sich die Farben auf die unterschiedlichen Heizraten beziehen. Das berechnete Modell stimmt nahezu perfekt mit den experimentellen Daten überein, was schließlich durch den Korrelationskoeffizienten von 0.99986 bestätigt wird.
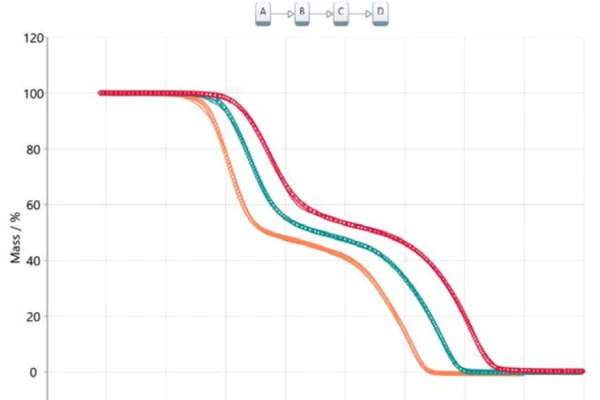
Die berechneten Parameter wie Präexponentialfaktor, Aktivierungsenergie und Reaktionsordnung sind in Tabelle 2 zusammengefasst. Alle Werte für die Aktivierungsenergie stimmen gut mit den vorgeschlagenen Werten des Ansatzes von Ozawa-Flynn-Wall sowie mit den Literaturwerten überein [6]. Der Beitrag der einzelnen Reaktionsstufen beträgt 40,3 %, 13,6 % und 46,1 %, was sehr gut mit den gemessenen Massenverluststufen korreliert.
Tabelle 2: Parameter als Ergebnis des modellbasieren Ansatzes unter Verwendung eines dreistufigen Folgemodells
| Parameter | 1. Stufe (Fn) | 2. Stufe (Fn) | 3. Stufe (Fn) |
|---|---|---|---|
| Log (PreExp) | 9,88 | 0,88 | 8,02 |
| EA (kJ/mol) | 101,3 | 30,7 | 116,6 |
| Reaktionsordnung | 1,01 | 0,91 | 0,77 |
| Beitrag (%) | 40,3 | 13,6 | 46,1 |
Zusammenfassung
In der Literatur wird für die Pyrolyse von Acetylsalicylsäure ein zweistufiger Mechanismus mit gleichzeitiger Verdampfung der Zwischenprodukte vorgeschlagen [6]. Long et al. bestimmten Essigsäure als Hauptkomponente der während der Massenverluststufe freigesetzten Gase. Darüber hinaus schlagen sie einen Pyrolysemechanismus vor, der eine Vielzahl von Oligomere bildet, die durch ihre charakteristischen Massen-Ladungsverhältnisse (amu) mit Hilfe der Massenspektrometrie (MS) nachgewiesen wurden [6][7]. Neben der Bestätigung, dass es sich bei den gasförmigen Hauptprodukten um Essigsäure, Salicylsäure, Phenol und Acetylsalicylsäure handelt gelang eine weitere Trennung und Identifizierung der Pyrolyseprodukte mit Hilfe der TG-GC-MS im Rahmen der bereits zitierten Arbeit [2]. Alle Autoren berichten von einer Überlagerung von Pyrolyse und Verdampfung zwischen 40 % und 60 % des Reaktionsverlaufs.
In dieser Arbeit konnten diese Ergebnisse in einen modellbasierten kinetischen Ansatz mit dreistufigem Folgemodell n-ter Ordnung implementiert werden. Die gute Übereinstimmung von experimentellen Daten und mathematischem Modell wird durch den Korrelationskoeffizienten von 0,99986 bestätigt. Die Werte für die Aktivierungsenergie stimmen zudem gut mit den in der Literatur berichteten Werten überein. Dennoch geht der hier vorgestellte modellbasierte Ansatz eines dreistufigen Folgemodells sicherlich einen ganzen Schritt weiter als die modellfreien Ansätze basierend auf Ozawa-Flynn-Wall und anderen [6], unter anderem, weil im hier vorgestellten Folgemodell für jeden der drei Reaktionsschritte unabhängige kinetische Daten ermittelt werden konnten.