Введение
В фармацевтике вряд ли найдется активное вещество, о котором написано больше, чем об ацетилсалициловой кислоте (сокращенно АСА; в англоязычных странах в качестве синонима часто используется даже торговое название Aspirin™). История ее успеха началась в конце XIX века, когда доктор Феликс Хоффманн впервые синтезировал это вещество в лабораториях BAYER без примесей. Сегодня это один из самых популярных фармацевтических препаратов, используемых в широком терапевтическом диапазоне. Он относится к группе нестероидных противовоспалительных препаратов (НПВП) и показан для лечения боли, лихорадки и воспаления. Кроме того, он используется для профилактики повторного инфаркта или инсульта у пациентов с высоким риском. В 1977 году АСА был добавлен в качестве анальгетика в "список основных лекарственных средств" ВОЗ (Всемирной организации здравоохранения) [1].
Это вторая из четырех заметок по применению, в которых более подробно рассматривается термическое поведение ацетилсалициловой кислоты: Разложение в различных газовых атмосферах, кинетика разложения и образующиеся газообразные вещества [2] [3] [4].
Кинетический анализ термоаналитических данных
С помощью данных измерений термоаналитических методов можно получить информацию о потере массы в результате разложения, пиролиза или горения, об энергетических изменениях, таких как плавление или кристаллизация, а также об изменении размеров образца в результате теплового расширения или спекания, например, в керамических материалах. Однако при этих утверждениях информационное содержание используется не полностью. С помощью более полного кинетического анализа можно также получить информацию о своевременном протекании реакции при различных температурах, т.е. о скорости реакции. Если ход реакции может быть достаточно хорошо описан с помощью системы математических уравнений, то можно также сделать предсказания о ходе реакции, которые экспериментально недостижимы или достижимы лишь с трудом. Это, в свою очередь, может быть использовано для оптимизации процессов или прогнозирования срока службы, окислительной стабильности или старения материалов и изделий.
Результаты и обсуждение
Для того чтобы лучше понять термическое поведение ацетилсалициловой кислоты, был использован кинетический подход в попытке найти систему математических уравнений для описания экспериментальных данных. Термическое поведение изучалось с помощью прибора NETZSCH TG 209 F1 Libra® при соблюдении условий измерения, приведенных в таблице 1. Кинетический подход требует проведения серии из как минимум трех различных скоростей нагрева для описания корреляции время-температура, что является основной целью кинетических оценок в целом.
Таблица 1: Параметры измерения ТГА
| Параметры | Ацетилсалициловая кислота |
|---|---|
| Масса образца [мг] | 4.982 │ 5.014 │ 5.053 |
| Атмосфера | Аргон |
| Тигель | Al2O3, 85 мкл, открытый |
| Температурная программа | RT - 450°C |
| Скорость нагрева [К/мин] | 3 │ 10 │ 30 |
| Скорость потока газа [мл/мин] | 40 |
| Держатель образца | ТГА |
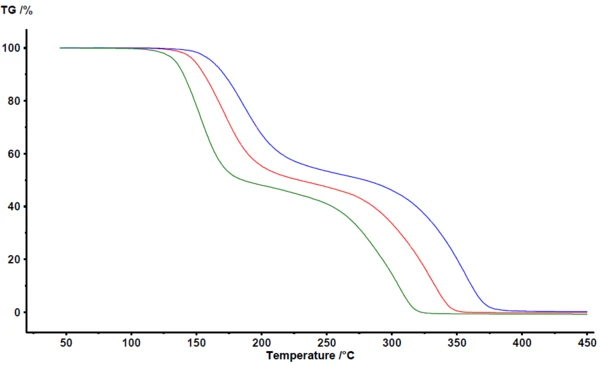
На рисунке 1 представлены результаты, полученные в программе анализа NETZSCH Proteus® . В интервале от 100 до 400 °C термогравиметрия обнаруживает две основные стадии потери массы при пиролизе ацетилсалициловой кислоты. Кривые ТГА смещаются в сторону более высоких температур с увеличением скорости нагрева. Параллельный сдвиг largely, а также практически одинаковая конечная масса указывают на то, что скорость нагрева сама по себе существенно не изменяет механизм реакции. Это также является явным признаком того, что механизм реакции в данном случае не очень сложен. С другой стороны, хорошо видно, что этапы потери массы не идеально разделены. Не видно плато, четко определяющего конец первого этапа потери массы или начало второго этапа потери массы. Как подтверждают такие методы сопряжения, как ТГА-ФТ-ИК, ТГА-МС или ТГА-ГХ-МС, пиролиз и испарение происходят одновременно [2][4][5].
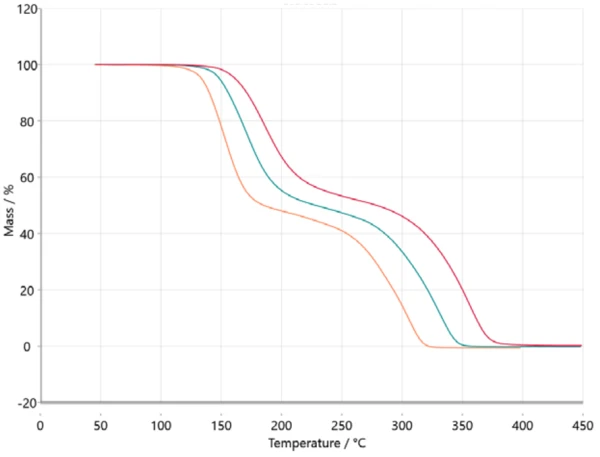
Для кинетического анализа данные измерений переносятся в программу NETZSCH Kinetics Neo в формате ASCII. Импортированные данные показаны на рисунке 2.
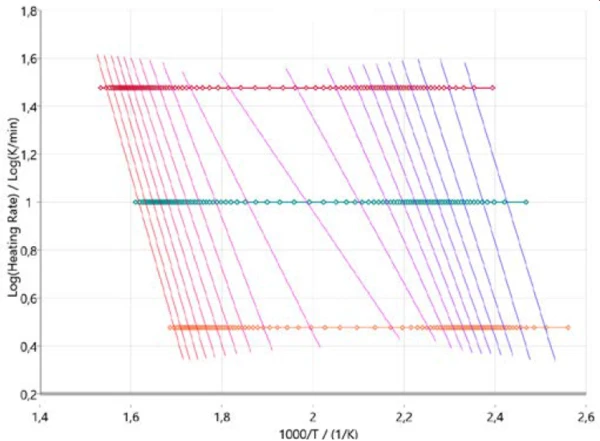
Для того чтобы получить первоначальное представление о механизме реакции, полезно начать кинетический анализ с так называемых безмодельных подходов. На рисунке 3 показаны результаты в соответствии с подходом Озавы-Флинна-Уолла, где логарифм скорости нагревания строится в зависимости от обратной температуры. Этот подход не только учитывает все измеренные точки данных, но и предоставляет информацию об изменении энергии активации, а также предэкспоненциального коэффициента на протяжении всего хода реакции (степень превращения). Это особенно полезно для многоступенчатых реакций. График описывает ход реакции (справа налево) для всех трех скоростей нагрева (горизонтальные символы). Почти вертикальные линии соединяют одинаковые степени превращения для каждой скорости нагрева и поэтому называются изоконверсионными линиями.
Эти изоконверсионные линии более или менее параллельны в диапазонах для двух основных стадий пиролиза в начале и в конце всего процесса. При конверсии около 50 % изоконверсионные линии имеют другой наклон, что указывает на изменение механизма реакции. На этой стадии реакции пиролиз и испарение происходят одновременно, как упоминалось ранее [2][4][5].
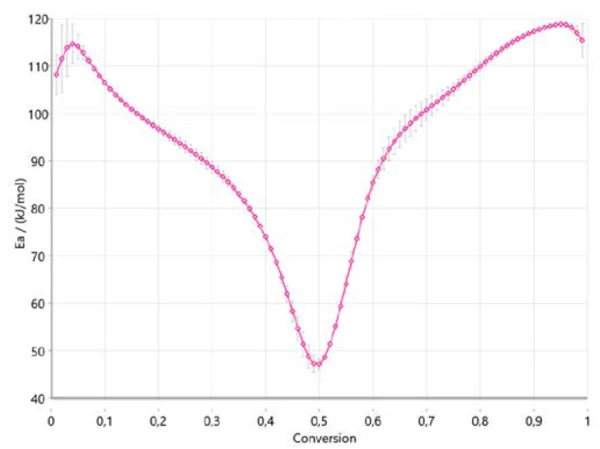
На рисунке 4 показано, как изменяется энергия активации по мере протекания реакции в соответствии с принципом Озавы-Флинна-Уолла. Это очень важная информация, поскольку она уже указывает на три диапазона для всего процесса: энергия активации около 110 кДж/моль в начале, около 40 кДж/моль между 40 и 50 % конверсией и около 120 кДж/моль в конце реакции. Изменение энергии активации с ростом степени конверсии подтверждает многоступенчатый механизм реакции. Полученные значения хорошо согласуются с результатами, опубликованными в литературе [6].
Перенос этой информации в анализ на основе модели приводит к трехступенчатой последовательной модели (t:FnFnFn), где A представляет собой исходный материал (ацетилсалициловая кислота), B и C - промежуточные продукты, известные из литературы [6, 7], а D - конечный продукт. В данном случае конечный продукт, конечно, не является веществом, но он характеризует окончание реакции или 100%-ную конверсию, поскольку остаточная масса для всех трех термогравиметрических кривых равна нулю. Все образующиеся продукты являются газообразными и поэтому испаряются из тигля при нагревании до конечной температуры. На рисунке 5 показан результат применения этого подхода, основанного на модели. Измеренные данные представлены в виде символов, а результаты для рассчитанной трехступенчатой последовательной модели - в виде сплошных линий, цвета которых соответствуют различным скоростям нагрева. Рассчитанная модель практически идеально соответствует экспериментальным данным, что подтверждается коэффициентом корреляции 0,99986.
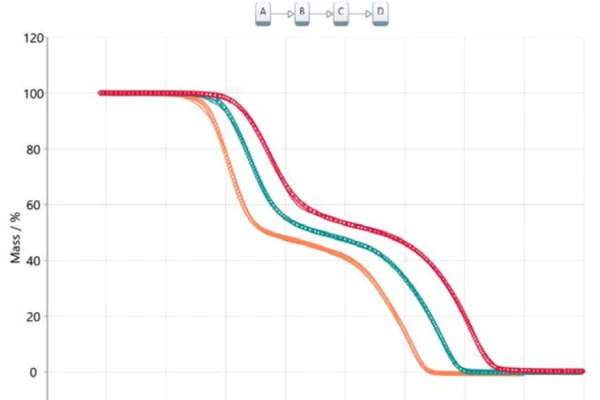
Рассчитанные параметры предэкспоненциального фактора, энергии активации и порядка реакции сведены в таблицу 2 для каждой отдельной стадии реакции. Все значения энергии активации находятся в хорошем согласии со значениями, предложенными в рамках подхода Озавы-Флинна-Уолла, а также со значениями, приведенными в литературе [6]. Вклад каждого из трех этапов реакции составляет 40,3 %, 13,6 % и 46,1 %, соответственно, что хорошо коррелирует с представленными этапами потери массы.
Таблица 2: Параметры, полученные в результате применения модельного подхода с использованием трехступенчатой последовательной модели n-го порядка
| Параметр | 1-й шаг (Fn) | 2-й шаг (Fn) | 3-й шаг (Fn) |
|---|---|---|---|
| Log (PreExp) | 9.88 | 0.88 | 8.02 |
| EA (кДж/моль) | 101.3 | 30.7 | 116.6 |
| Порядок реакции | 1.01 | 0.91 | 0.77 |
| Вклад (%) | 40.3 | 13.6 | 46.1 |
Заключение
Механизм пиролиза ацетилсалициловой кислоты, предложенный в литературе, представляет собой двухступенчатый механизм с одновременным испарением промежуточных продуктов [6]. Грегори и др. обнаружили, что уксусная кислота является основным соединением, выделяющимся на первом этапе потери массы. Кроме того, они предполагают механизм пиролиза с образованием различных олигомеров, на что указывают атомные единицы массы (amu), определяемые с помощью масс-спектрометрии (МС) [6][7]. Наряду с подтверждением того, что основными газообразными продуктами являются уксусная кислота, салициловая кислота, фенол и ацетилсалициловая кислота, для выделения и идентификации других продуктов пиролиза был использован еще более сложный метод сопряжения ТГА-ГХ-МС [2]. Все авторы сообщают о наложении пиролиза и испарения между 40 и 60 % хода реакции.
В настоящей работе удалось реализовать эти результаты в модельном кинетическом подходе с использованием трехступенчатой последовательной модели n-го порядка. Хорошая корреляция между экспериментальными данными и математической моделью подтверждается коэффициентом корреляции 0,99986. Значения энергии активации, например, находятся в хорошем согласии со значениями, приведенными в литературе. Тем не менее, представленный здесь модельный подход трехступенчатой последовательной модели, безусловно, является шагом вперед по сравнению с изоконверсионными безмодельными подходами, основанными, в частности, на методе Озавы-Флинна-Уолла и других [6], поскольку кинетические данные доступны независимо для каждой отдельной ступени реакции.