Introduzione
In farmacia non c'è quasi nessun principio attivo su cui si sia scritto di più dell'acido acetilsalicilico (o ASA in breve; nei paesi di lingua inglese anche il nome di marca Aspirin™ è spesso usato come sinonimo). La sua storia di successo è iniziata alla fine del XIX secolo, quando il Dr. Felix Hoffmann sintetizzò per la prima volta la sostanza nei laboratori BAYER senza impurità. Al giorno d'oggi, è ancora uno dei farmaci più popolari, utilizzato in un ampio spettro terapeutico. Appartiene al gruppo dei farmaci antinfiammatori non steroidei (FANS) ed è indicato per il trattamento di dolore, febbre e infiammazione. Inoltre, viene utilizzato per prevenire le recidive di infarto o ictus in pazienti ad alto rischio. Nel 1977, l'ASA è stato aggiunto come analgesico alla "lista dei farmaci essenziali" dell'OMS (Organizzazione Mondiale della Sanità) [1].
Questa è la seconda di quattro note applicative che approfondiscono il comportamento termico dell'acido acetilsalicilico: Decomposizione in diverse atmosfere gassose, cinetica di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione e specie gassose risultanti [2] [3] [4].
Analisi cinetica dei dati termoanalitici
Con i dati di misura dei metodi termoanalitici si possono ottenere informazioni sulla perdita di massa dovuta a Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione, PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi o combustione, sui cambiamenti energetici come laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione o la CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione o anche sui cambiamenti nelle dimensioni del campione dovuti all'espansione termica o alla SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione, ad esempio nei materiali ceramici. Con queste affermazioni, tuttavia, il contenuto informativo non viene utilizzato in modo esaustivo. Con l'aiuto di un'analisi cinetica più completa, è anche possibile ottenere informazioni sull'andamento puntuale di una reazione a diverse temperature, cioè sulla velocità di reazione. Se il decorso di una reazione può essere descritto sufficientemente bene con l'aiuto di un sistema di equazioni matematiche, è anche possibile fare previsioni sul decorso della reazione che sperimentalmente non sono accessibili o lo sono solo con difficoltà. Questo, a sua volta, può essere utilizzato per ottimizzare i processi o per prevedere la durata, la stabilità ossidativa o il comportamento di invecchiamento di materiali e prodotti.
Risultati e discussione
Per comprendere meglio il comportamento termico dell'acido acetilsalicilico, è stato effettuato un approccio cinetico nel tentativo di trovare un sistema di equazioni matematiche per la descrizione dei dati sperimentali. Il comportamento termico è stato studiato utilizzando un NETZSCH TG 209 F1 Libra® e applicando le condizioni di misura riassunte nella Tabella 1. Un approccio cinetico richiede una serie di almeno tre diverse velocità di riscaldamento per descrivere la correlazione tempo-temperatura, che è l'obiettivo principale delle valutazioni cinetiche in generale.
Tabella 1: Parametri di misurazione TGA
| Parametri | Acido acetilsalicilico |
|---|---|
| Massa del campione [mg] | 4.982 │ 5.014 │ 5.053 |
| Atmosfera | Argon |
| Crogiolo | Al2O3, 85 μl, aperto |
| Programma di temperatura | RT - 450°C |
| Velocità di riscaldamento [K/min] | 3 │ 10 │ 30 |
| Portata di gas [ml/min] | 40 |
| Supporto del campione | TGA |
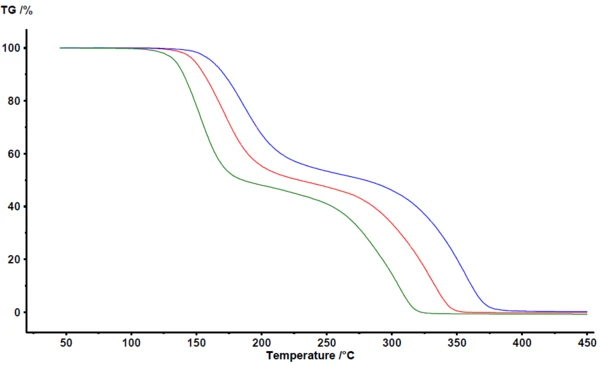
La Figura 1 illustra i risultati ottenuti nel software di analisi NETZSCH Proteus® . Tra 100°C e 400°C, la termogravimetria rileva due fasi principali di perdita di massa per la PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi dell'acido acetilsalicilico. Le curve TGA si spostano verso temperature più elevate con l'aumento della velocità di riscaldamento. Lo spostamento parallelo largee la massa finale quasi identica indicano che la velocità di riscaldamento non modifica in modo significativo il meccanismo di reazione. Questa è anche una chiara indicazione che il meccanismo di reazione non è molto complesso in questo caso. D'altra parte, si può notare chiaramente che le fasi di perdita di massa non sono perfettamente separate. Non è visibile un plateau che definisca chiaramente la fine della prima fase di perdita di massa o l'inizio della seconda fase di perdita di massa. Come confermato da tecniche di accoppiamento come TGA-FT-IR, TGA-MS o TGA-GC-MS, sia la PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi che l'evaporazione avvengono simultaneamente [2][4][5].
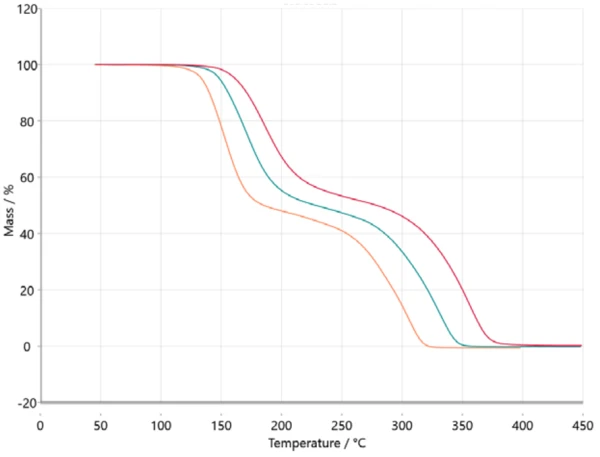
Per l'analisi cinetica, i dati misurati vengono trasferiti nel software NETZSCH Kinetics Neo via ASCII. I dati importati sono rappresentati nella figura 2.
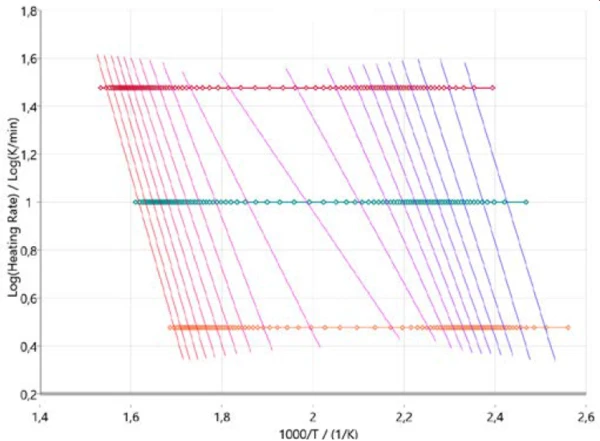
Per avere un'idea iniziale del meccanismo di reazione, è utile iniziare l'analisi cinetica con i cosiddetti approcci model-free. La Figura 3 mostra i risultati secondo Ozawa-Flynn-Wall, dove il logaritmo della velocità di riscaldamento è tracciato in funzione della temperatura inversa. Questo approccio non solo considera tutti i punti dati misurati, ma fornisce anche informazioni sulla variazione dell'energia di attivazione e del fattore preesponenziale durante l'intero corso della reazione (grado di conversione). Ciò è particolarmente utile per le reazioni a più fasi. Il grafico descrive la progressione della reazione (da destra a sinistra) per tutte e tre le velocità di riscaldamento (simboli orizzontali). Le linee quasi verticali collegano lo stesso grado di conversione per ogni velocità di riscaldamento e sono quindi chiamate linee isoconversionali.
Queste linee isoconversionali sono più o meno parallele agli intervalli per le due fasi principali della PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi all'inizio e alla fine dell'intero processo. A circa il 50% di conversione, le linee isoconversionali mostrano una diversa pendenza che indica un cambiamento nel meccanismo di reazione. In questa fase della reazione, la PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi e l'evaporazione avvengono contemporaneamente, come già detto [2][4][5].
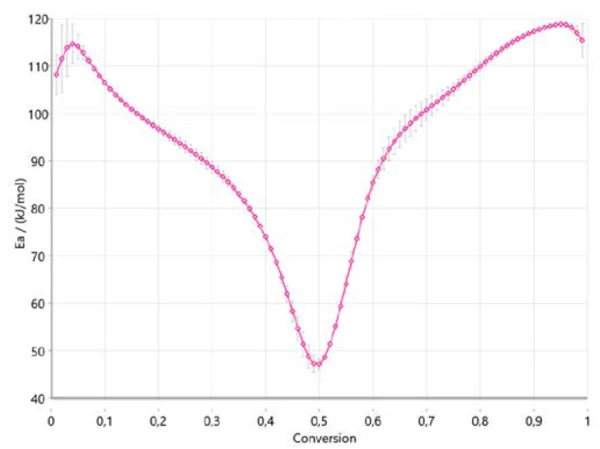
La Figura 4 mostra come cambia l'energia di attivazione con il progredire della reazione, in accordo con Ozawa-Flynn-Wall. Si tratta di un'informazione molto importante, poiché indica già tre intervalli per l'intero processo, con un'energia di attivazione di circa 110 kJ/mol all'inizio, di circa 40 kJ/mol tra il 40% e il 50% di conversione e di circa 120 kJ/mol alla fine della reazione. La variazione dell'energia di attivazione con il grado di conversione conferma un meccanismo di reazione a più fasi. I valori ottenuti sono in buona correlazione con i risultati pubblicati in letteratura [6].
Il trasferimento di queste informazioni in un'analisi basata su modelli porta a un modello a tre fasi consecutive (t:FnFnFn), dove A rappresenta il materiale di partenza (acido acetilsalicilico), B e C sono intermedi noti in letteratura [6, 7] e D è il prodotto finale. In questo caso, il prodotto finale non è, ovviamente, una vera e propria sostanza, ma descrive la fine della reazione o il 100% di conversione, poiché la massa residua per tutte e tre le curve termogravimetriche è pari a zero. Tutti i prodotti formati sono gassosi e quindi evaporano dal crogiolo durante il riscaldamento alla temperatura finale. La Figura 5 illustra il risultato di questo approccio basato sul modello. I dati misurati sono presentati come simboli e i risultati del modello calcolato a tre fasi consecutive sono presentati come linee solide con i colori relativi alle diverse velocità di riscaldamento. Il modello calcolato si adatta quasi perfettamente ai dati sperimentali, come confermato dal coefficiente di correlazione di 0,99986.
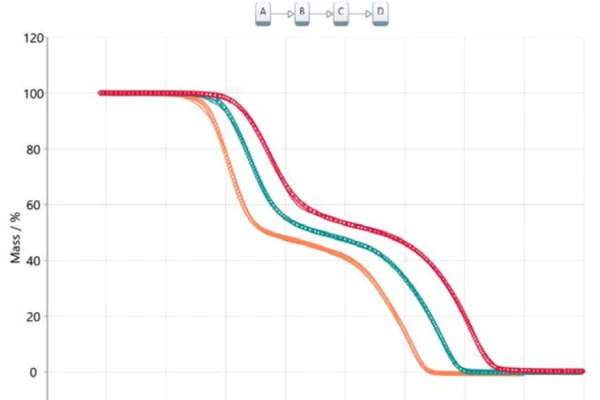
I parametri calcolati del fattore pre-esponenziale, dell'energia di attivazione e dell'ordine di reazione sono riassunti nella tabella 2 per ogni singola fase di reazione. Tutti i valori dell'energia di attivazione sono in buon accordo con quelli suggeriti dall'approccio Ozawa-Flynn-Wall e con quelli riportati in letteratura [6]. Il contributo di ciascuna delle tre fasi di reazione è rispettivamente del 40,3%, 13,6% e 46,1%, che si correla bene con le fasi di perdita di massa presentate.
Tabella 2: Parametri risultanti dall'approccio basato sul modello utilizzando un modello consecutivo a tre fasi di ordine n
| Parametro | 1° passo (Fn) | 2° passo (Fn) | 3° passo (Fn) |
|---|---|---|---|
| Log (PreExp) | 9.88 | 0.88 | 8.02 |
| EA (kJ/mol) | 101.3 | 30.7 | 116.6 |
| Ordine di reazione | 1.01 | 0.91 | 0.77 |
| Contributo (%) | 40.3 | 13.6 | 46.1 |
Conclusione
Il meccanismo di PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi dell'acido acetilsalicilico suggerito in letteratura è un meccanismo a due fasi con evaporazione simultanea degli intermedi [6]. Gregory et al. hanno riscontrato che l'acido acetico è il principale composto rilasciato durante la prima fase di perdita di massa. Inoltre, suggeriscono un meccanismo di PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi che forma una varietà di oligomeri, come indicato dalle unità di massa atomica (amu) rilevate con la spettrometria di massa (MS) [6][7]. Oltre alla conferma che i principali prodotti gassosi sono l'acido acetico, l'acido salicilico, il fenolo e l'acido acetilsalicilico, è stata utilizzata una tecnica di accoppiamento TGA-GC-MS ancora più sofisticata per separare e identificare ulteriori prodotti di PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi [2]. Tutti gli autori riportano una sovrapposizione di PirolisiLa pirolisi è la decomposizione termica di composti organici in atmosfera inerte.pirolisi ed evaporazione tra il 40% e il 60% del progresso della reazione.
Nel presente lavoro, è stato possibile implementare questi risultati in un approccio cinetico basato su un modello a tre fasi consecutive di ordine n-esimo. La buona correlazione tra i dati sperimentali e il modello matematico è confermata dal coefficiente di correlazione di 0,99986. I valori dell'energia di attivazione, ad esempio, sono in buon accordo con i valori riportati in letteratura. Tuttavia, l'approccio basato su un modello a tre fasi consecutive qui introdotto è sicuramente un passo avanti rispetto agli approcci iso-conversionali privi di modello basati su Ozawa-Flynn-Wall o altri [6], tra gli altri, poiché i dati cinetici sono disponibili indipendentemente per ogni singola fase di reazione.