Introduzione
Per studiare l'effetto della dimensione delle particelle sulle proprietà fisiche dei materiali cristallini, diverse dimensioni delle particelle di sostanze cristalline generate dalla macinazione sono state analizzate con metodi di analisi termica, come la termogravimetria (TGA) [1], la calorimetria differenziale a scansione (DSC) [2] e la dilatometria [3].
Variazioni relativamente small delle dimensioni delle particelle hanno prodotto cambiamenti significativi nei processi termici che sono stati analizzati con questi metodi.
I processi termici analizzati possono essere suddivisi in quattro categorie:
- Fusione di metalli (solido-liquido)
- Reazioni sulla superficie delle particelle (combustione del carbonio)
- Rilascio di prodotti di reazione gassosi (disidratazione e Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione)
- SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. Sinterizzazione
Fusione
Secondo Schmid [4], la variazione delle dimensioni delle particelle nell'intervallo dei milli e micrometri non influisce in modo significativo sul comportamento diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione delle particelle. Per le particelle sferiche con diametro superiore a 50 nm, le particelle in superficie rappresentano meno del 6% del bulk e hanno quindi un effetto trascurabile. Per particelle di smalldimensioni (r < 25 nm), la percentuale di particelle coordinativamente insature vicino alla superficie aumenta, causando una diminuzione significativa dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione [6] secondo il modello di Reifenberger [5].
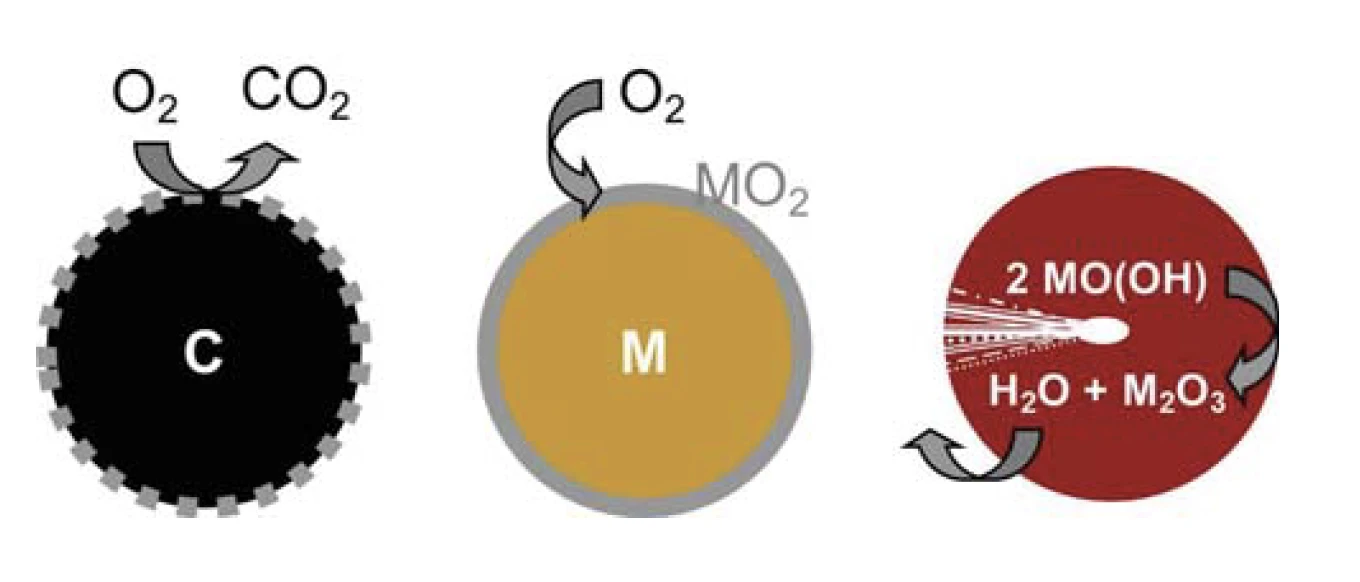
Reazioni sulla superficie delle particelle
La combustione di particelle di carbonio può essere utilizzata come modello di reazione superficiale. L'ossigeno gassoso può essere fornito uniformemente alla superficie delle particelle e reagisce lì per formareCO2, un prodotto gassoso e quindi facilmente rimovibile. Una superficie fresca e reattiva è generata dalla reazione stessa. La particella di carbonio diminuisce di dimensioni fino alla completa conversione inCO2. Al contrario, lo strato superficiale di ossido metallico prodotto durante l'OssidazioneL'ossidazione può descrivere diversi processi nel contesto dell'analisi termica.ossidazione delle particelle metalliche presenta uno strato barriera passivo che ostacola l'accesso dell'ossigeno al nucleo metallico oltre un certo spessore, impedendo così la conversione quantitativa (Figura 1).
Risultati della misurazione
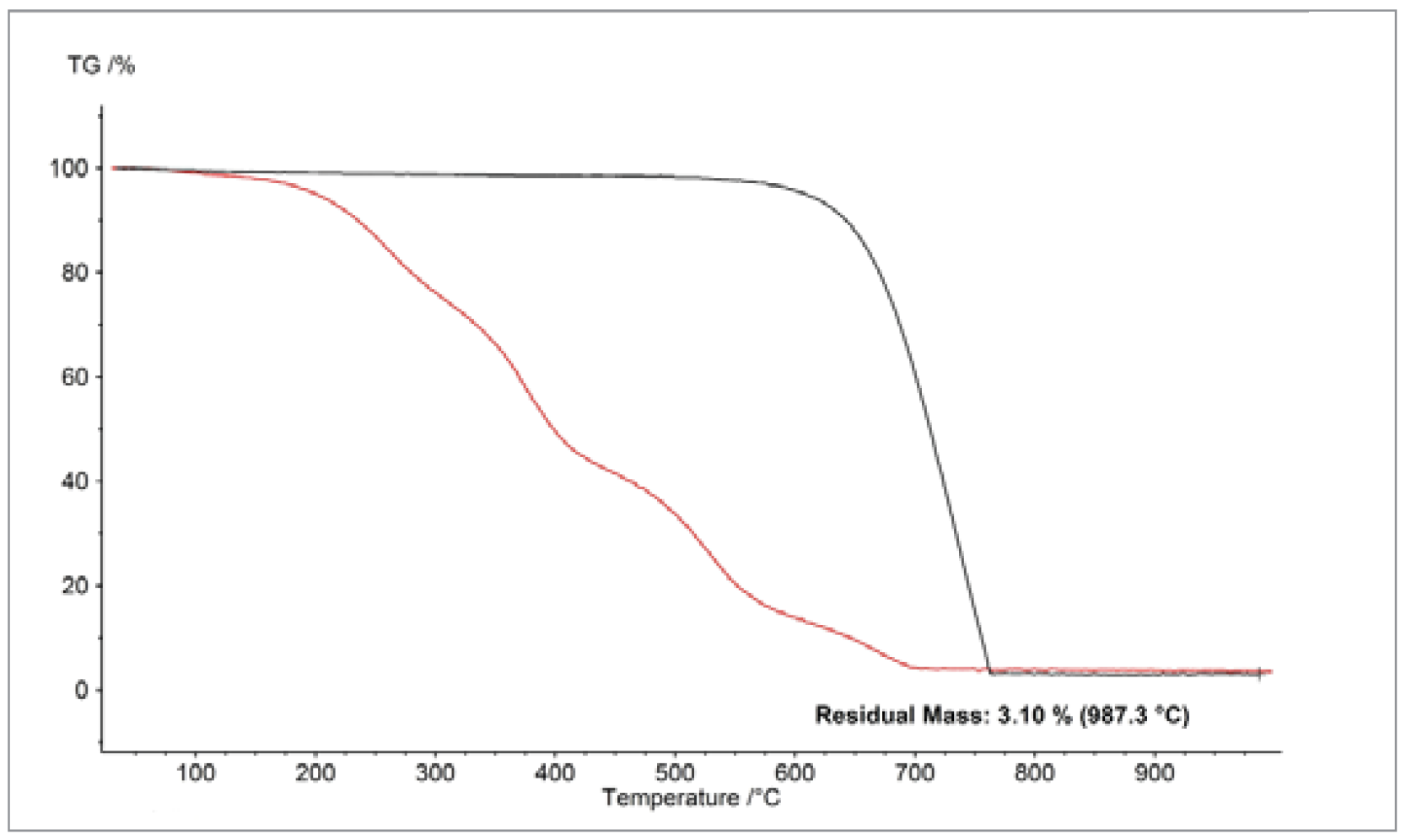
Nonostante le dimensioni delle particelle siano paragonabili (~50 nm), i diversi tipi di nerofumo hanno mostrato un comportamento di combustione molto diverso, come mostrato nella figura 2. Le differenze sono probabilmente dovute alla diversa porosità dei materiali, che influisce sulle loro aree superficiali. Le differenze sono probabilmente dovute alla diversa porosità dei materiali, che influisce sulle loro aree superficiali. Pertanto, la sola dimensione delle particelle è solo una determinazione approssimativa del comportamento di OssidazioneL'ossidazione può descrivere diversi processi nel contesto dell'analisi termica.ossidazione.
Rilascio di prodotti di reazione gassosi
Sebbene le Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. reazioni di decomposizione non richiedano alcun reagente gassoso aggiuntivo, sono comunque significativamente influenzate dai processi di trasporto. Sebbene l'area superficiale non sia cruciale in questo caso, la distanza su cui i gas rilasciati devono essere trasportati dall'interno alla superficie della particella attraverso pori o canali dipende dalle dimensioni della particella. Pertanto, questo processo è molto più efficiente per le particelle molto small.
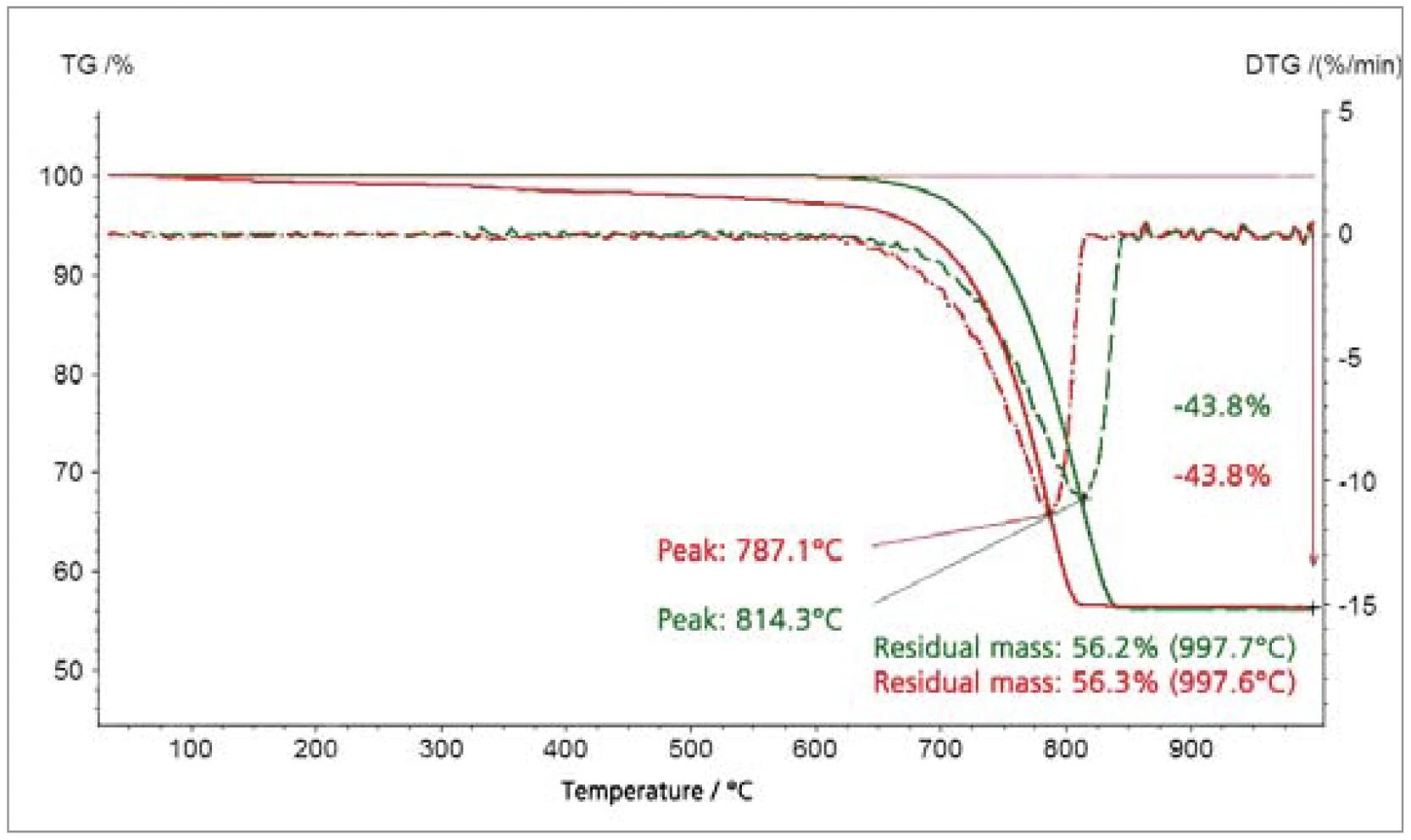
Gli esempi del CaCO3 (figura 3) e della goethite (figura 4) illustrano l'effetto della smalldimensione delle particelle nell'abbassare le temperature a cui i materiali si decompongono con il rilascio diCO2 oH2O[6]. I risultati termogravimetrici dimostrano che le stechiometrie dei gas rilasciati non sono influenzate dalla variazione delle dimensioni delle particelle.
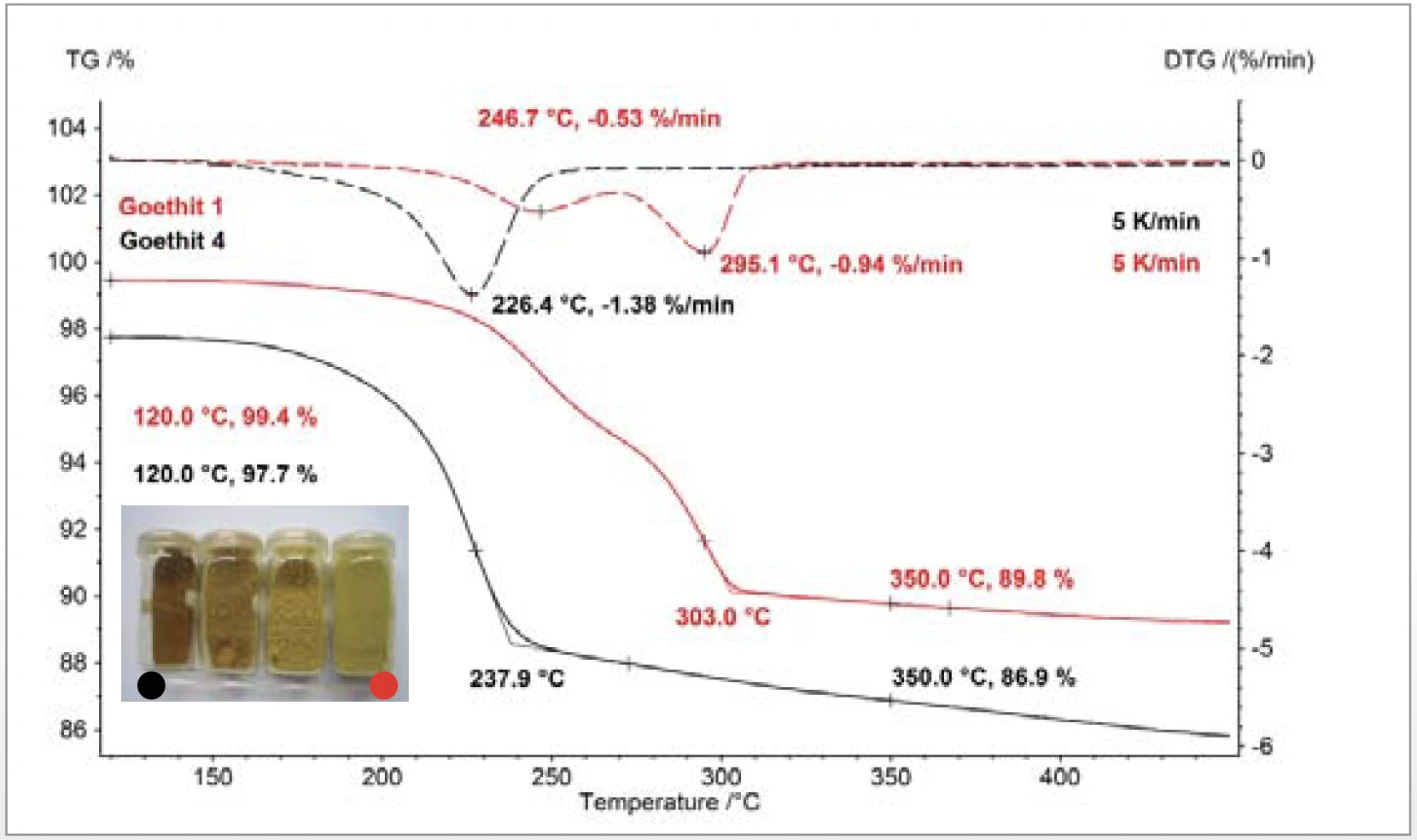
L'analisi termocinetica della disidratazione di α-FeOOH (goethite) in α-Fe2O3 (ematite) ha mostrato che il modello cinetico formale per la reazione è più semplice per le particelle small che per le particelle large. Le misure effettuate a diverse velocità di riscaldamento sono state modellate da un processo di reazione costituito da due fasi consecutive del nono ordine e da un'energia di attivazione di 150 kJ/mol [7]. La quantificazione delle fasi di perdita di massa tra 120°C e 350°C corrisponde ai valori previsti per la conversione stechiometrica della goethite in ematite. Il tasso di perdita di massa (DTG) - indicato con linee tratteggiate - mostra che il picco di reazione si sposta a temperature più basse con smaller le dimensioni delle particelle. La foto in figura 4 mostra il cambiamento di aspetto dei campioni di goethite al variare delle dimensioni delle particelle.
Sinterizzazione
Gli effetti dipendenti dalle dimensioni delle particelle osservati durante la SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione di pellet di polvere pressata non possono essere spiegati solo dall'aumento dell'area superficiale (Figura 5). A differenza del comportamento diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione, gli effetti dimensionali delle particelle sulla SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione si verificano a large dimensioni dell'ordine dei micrometri. Riduzioni significative della temperatura di SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione si verificano con una variazione relativamente small della dimensione delle particelle.
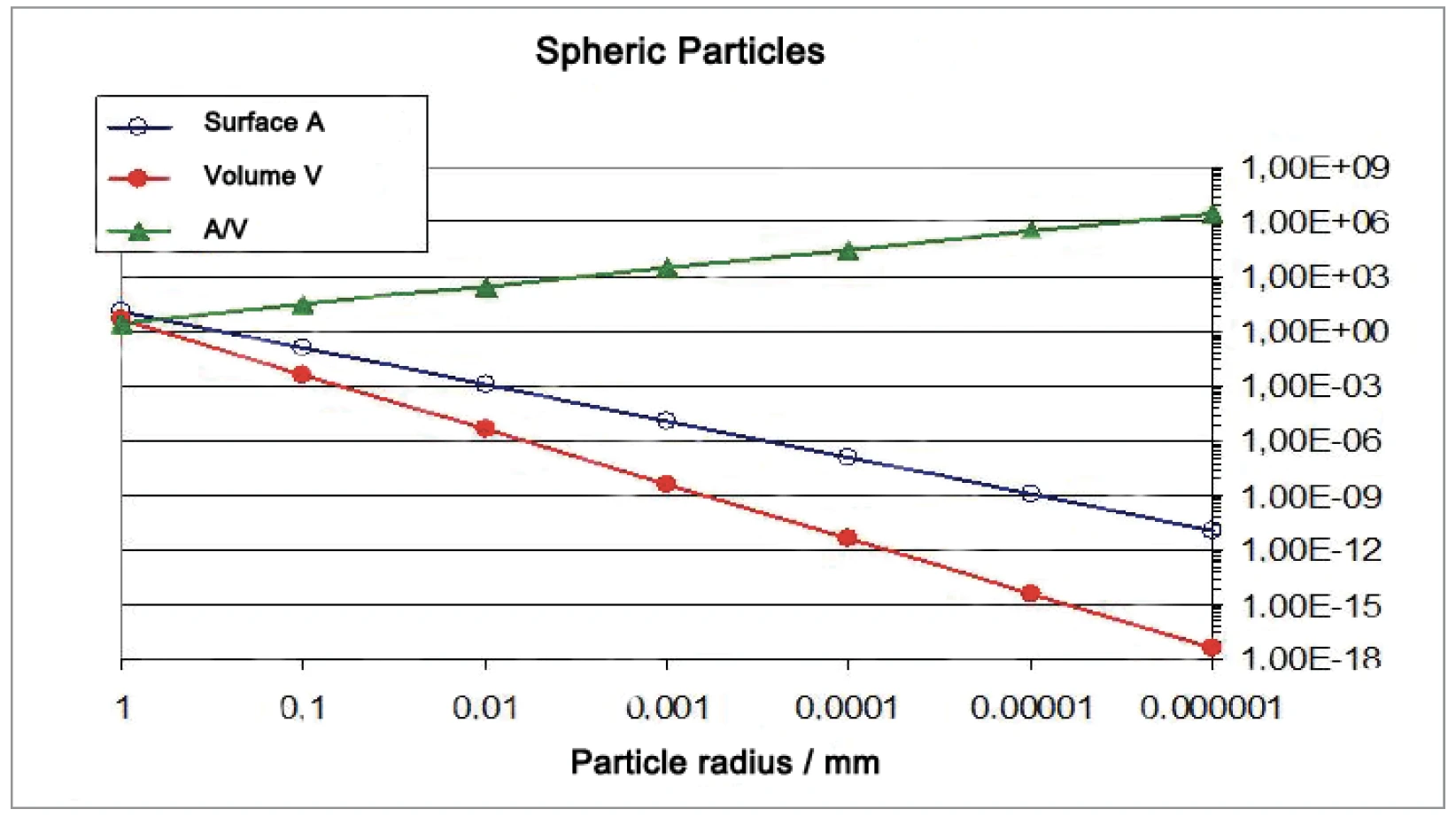
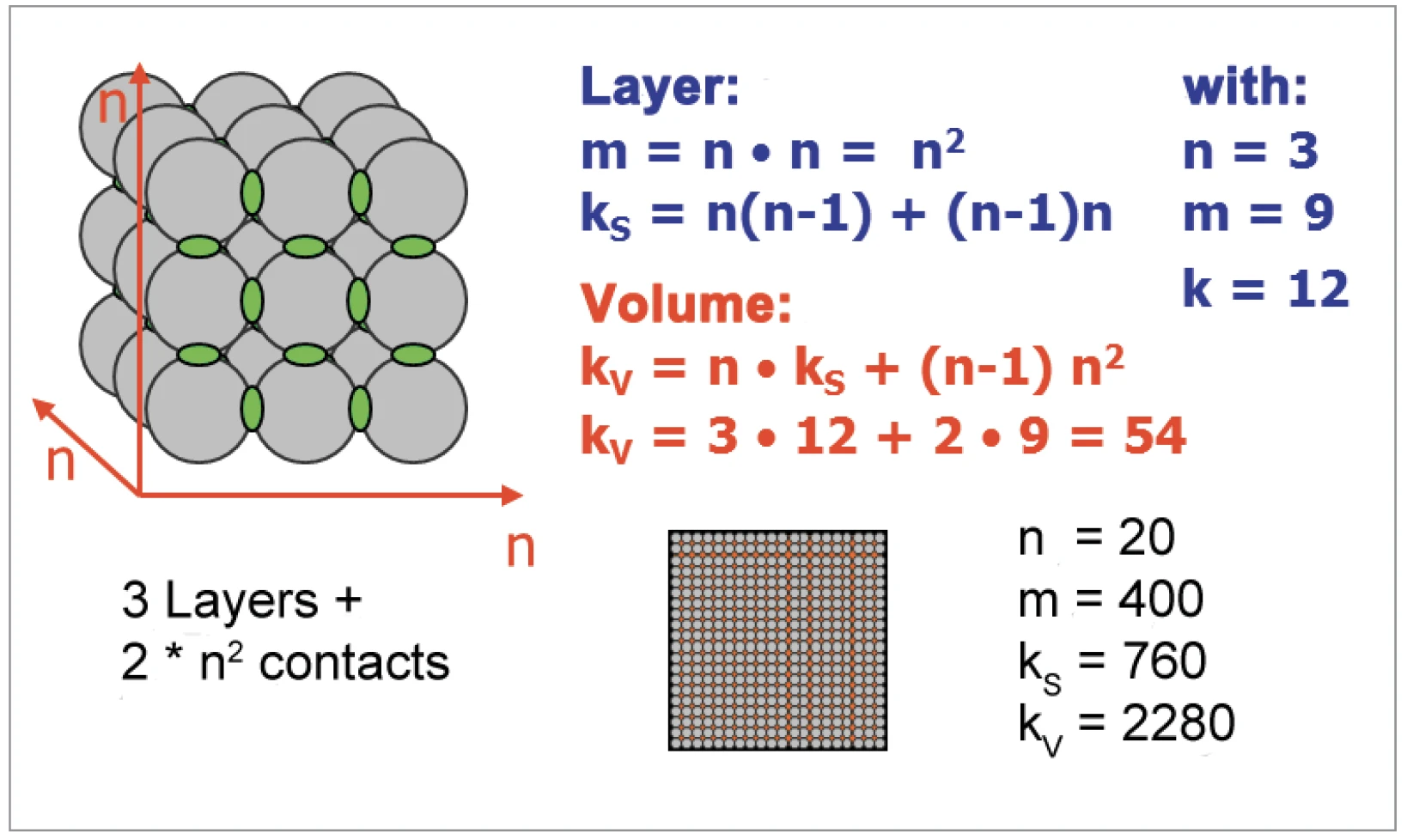
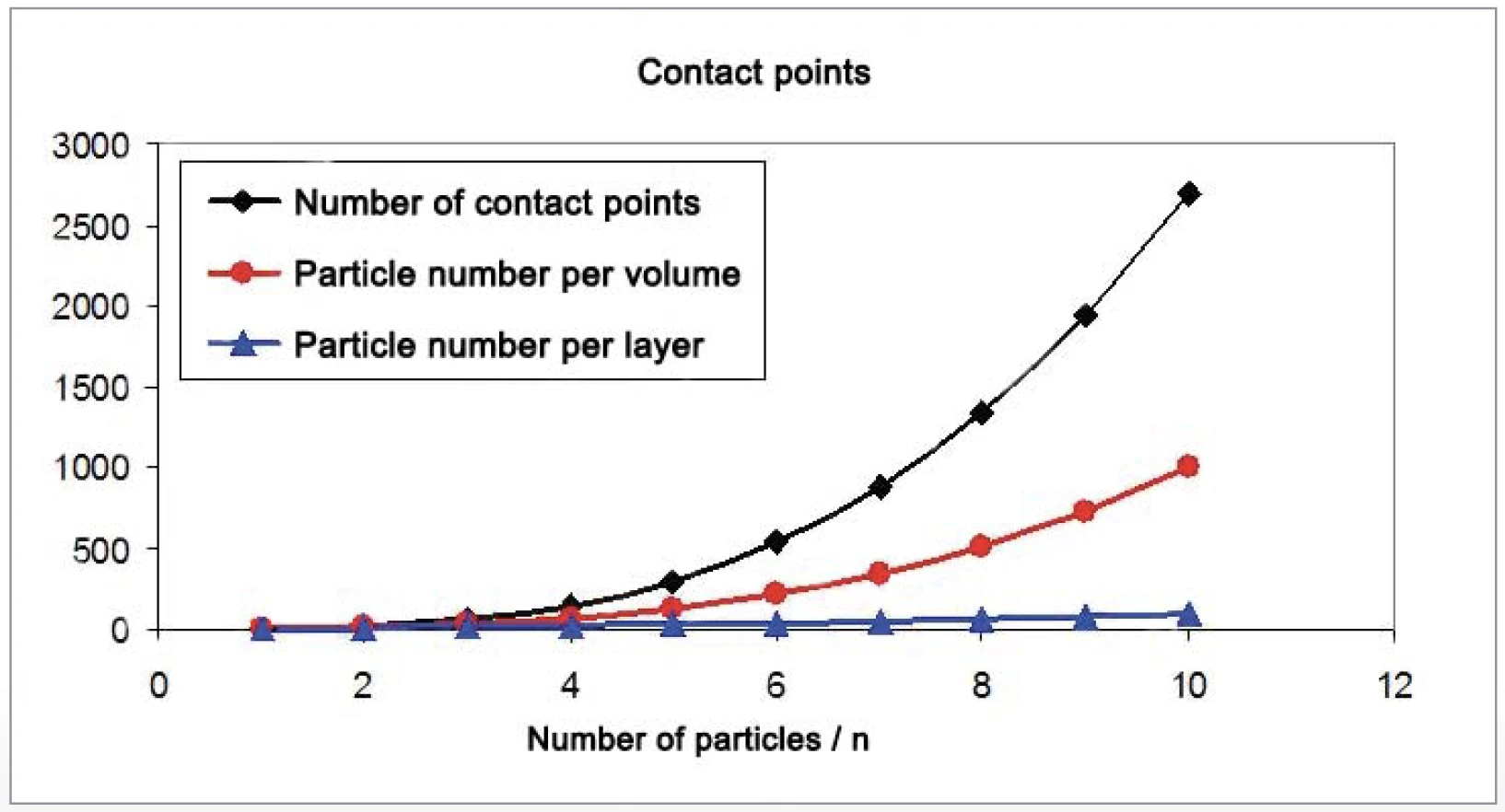
La quantità di punti di contatto tra le particelle sferiche aumenta molto più rapidamente del rapporto superficie/volume (figure 6 e 7). Per l'aumento dell'attività di SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione, i punti di contatto tra le particelle sono importanti. Le particelle di diametro compreso tra 10 μm e 130 nm sono state generate macinando i materiali con il sistema di macinazione a battitura NETZSCH ZETA® RS4.
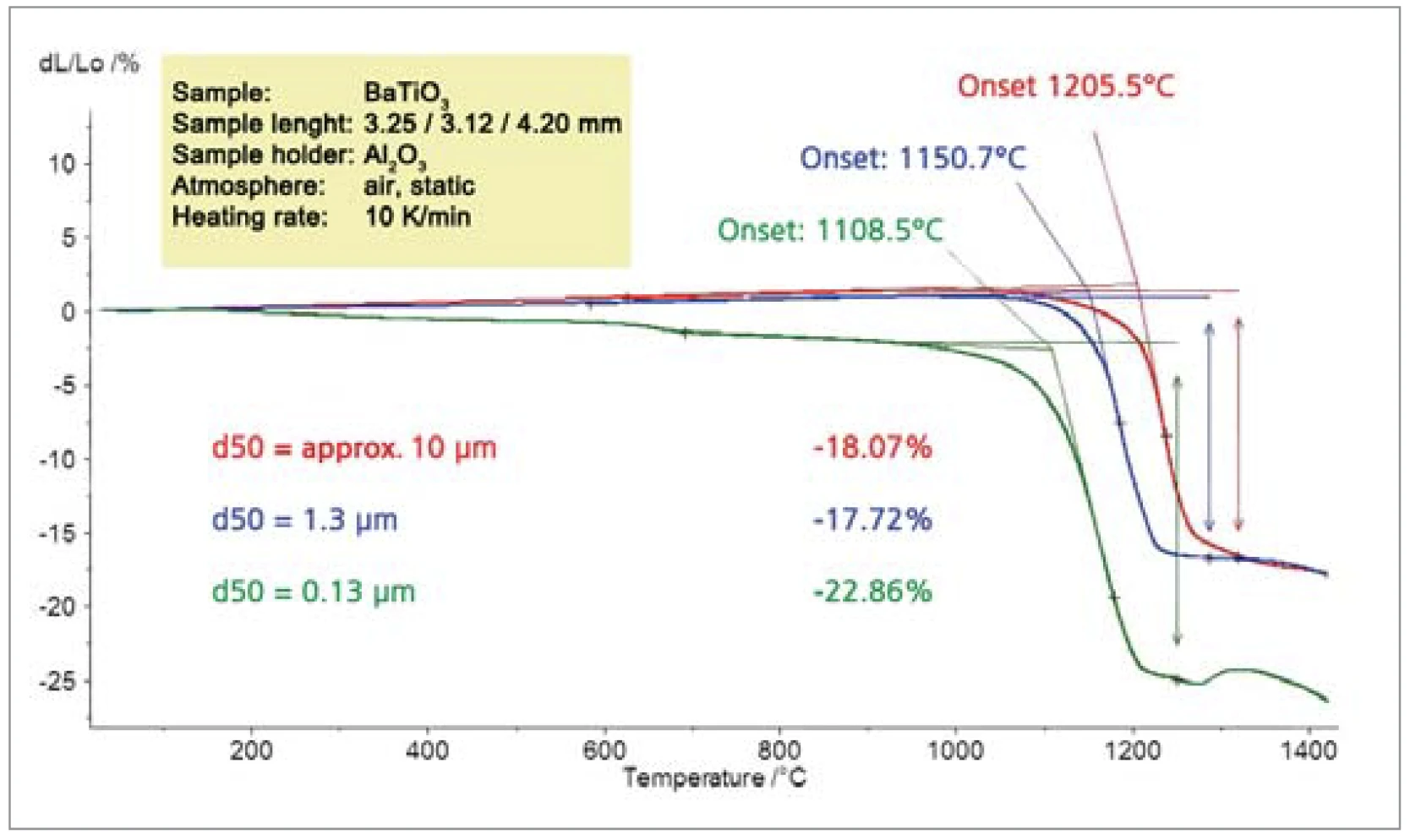
La Figura 8 mostra la dipendenza dell'attività di SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione dalle dimensioni delle particelle di BaTiO3. La temperatura di SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione di 1108°C per le particelle smallest (temperatura di insorgenza extra-polverizzata) è inferiore di quasi 100 K rispetto alla temperatura di SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione delle particelle larger (1205°C).
Sintesi
Con l'aiuto di misure termoanalitiche, è stato possibile dimostrare che la dimensione delle particelle ha un effetto significativo sulla cinetica e, quindi, sulla dipendenza dalla temperatura di processi quali disidratazione, Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione, combustione e SinterizzazioneLa sinterizzazione è un processo di produzione per la formazione di un corpo meccanicamente resistente a partire da una polvere ceramica o metallica. sinterizzazione. La preparazione del campione, in particolare la dimensione delle particelle, è quindi un parametro importante da considerare nell'interpretazione dei risultati delle misure.
I metodi di analisi termica offrono un mezzo relativamente facile e veloce per misurare gli effetti delle dimensioni delle particelle sulle proprietà del campione.