Introduzione
Quando l'acqua entra in contatto con una sostanza cristallina, sono possibili diversi tipi di interazioni: Le molecole d'acqua possono semplicemente adsorbire sulla superficie; l'acqua liquida condensata può apparire sul solido (nel caso della deliquescenza o della condensazione capillare); oppure, l'acqua può addirittura essere incorporata nella struttura cristallina (assorbimento), formando idrati stechiometrici o non stechiometrici [1]. Durante il riscaldamento, a sua volta, sono necessarie diverse quantità di energia per superare queste interazioni e rompere i legami formati. Ecco perché a volte si osservano diverse fasi di perdita di massa quando un idrato viene riscaldato; le molecole d'acqua adsorbite sulla superficie si desorbono per prime, seguite dall'acqua legata in modo più forte.
Per la progettazione di un processo di disidratazione, è quindi molto importante conoscere le proprietà termiche del particolare campione. L'analisi termogravimetrica in combinazione con la valutazione cinetica è estremamente utile in questo caso perché può aiutare a ridurre significativamente il tempo necessario per sviluppare un programma di temperatura adeguato. Se le misure termiche vengono eseguite con sistemi sillabati, ad esempio con TGA o STA accoppiati a un sistema di analisi dei gas come l'FT-IR, è inoltre possibile scoprire se il gas evoluto durante il riscaldamento è davvero solo acqua o se sono coinvolti altri volatili.
Il magnesio-stearato come sostanza modello -Sperimentale
Il magnesio stearato è uno degli eccipienti più utilizzati in campo farmaceutico. Viene tipicamente utilizzato come lubrificante aggiunto alle forme di dosaggio solide, come le compresse. Molti tipi di magnesio stearato in commercio sono composti da una miscela di vari idrati: monoidrato (ordinato o disordinato), diidrato e/o triidrato. [2] Per la presente serie di esperimenti, circa 6,5 mg di stearato di magnesio in polvere, come ricevuto, sono stati riscaldati a velocità di riscaldamento comprese tra 2 K/min e 20 K/min utilizzando un dispositivo NETZSCH TG 209 F1 . L'insieme completo dei parametri di misura è riportato nella tabella 1.
Tabella 1: Parametri di misura
| Parametri | Stearato di magnesio |
|---|---|
| Massa del campione | Circa 6,5 mg |
| Atmosfera | Azoto |
| Crogiolo | Al, aperto |
| Programma di temperatura | Da RT a 180°C |
| Velocità di riscaldamento | 2, 5, 10 e 20 K/min |
| Velocità di flusso | 40 ml/min |
| Supporto del campione | TGA, tipo P |
Risultati e discussione
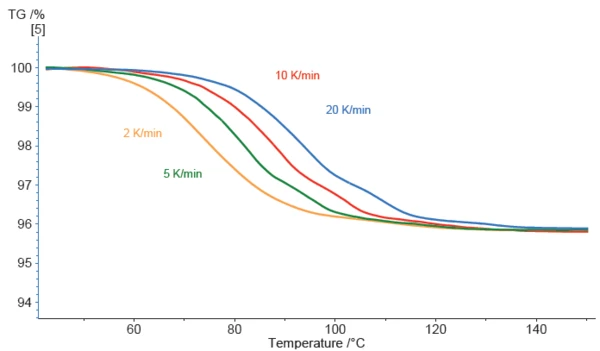
La perdita di massa osservata del campione di stearato di magnesio inizia abbastanza presto. Nella curva eseguita a 2 K/min, una deviazione è già visibile a circa 50°C.
Più alta è la velocità di riscaldamento applicata, più le curve si spostano verso temperature più elevate, il che è caratteristico degli effetti cinetici. Inoltre, le curve a velocità di riscaldamento più elevate presentano una struttura più evidente. Nella curva blu (eseguita a 20 K/min), si possono chiaramente rilevare tre fasi di perdita di massa. Ciò indica che la riduzione della velocità di riscaldamento non sempre migliora la separazione degli effetti sovrapposti; a volte è vero il contrario, come nel presente esempio. Pertanto, la cinetica alla base degli effetti di perdita di massa è fondamentale.
Per saperne di più sulla cinetica degli effetti di perdita di massa, è stato applicato il software NETZSCH Kinetics Neo. Utilizzando il software, è stato possibile adattare bene i dati sperimentali applicando un modello consecutivo a tre fasi di reazioni del nono ordine (t:FnFnFn, vedi fig. 2)
A → B → C → D
Il corrispondente coefficiente di correlazione R2, che è un indicatore della qualità dell'adattamento, è stato determinato pari a 0,99993.
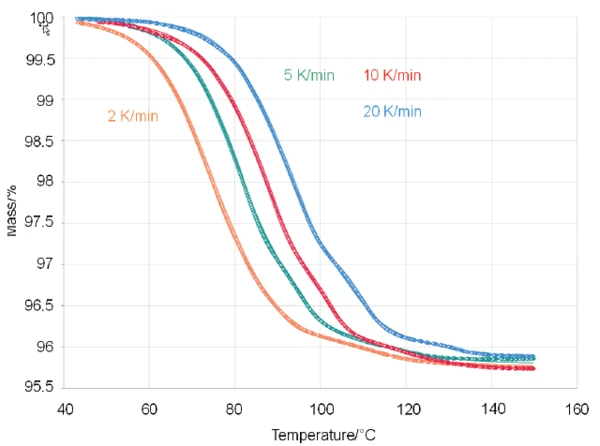
Kinetics Neo è un software di cinetica formale in grado di analizzare diversi tipi di processi chimici dipendenti dalla temperatura, sia che siano associati, tra le altre possibilità, a una variazione di massa, di lunghezza o di entalpia. Kinetics Neo può lavorare sulla base di metodi privi di modelli e basati su modelli. L'approccio cinetico basato su modelli è in grado di fornire informazioni su ogni fase di reazione e sui relativi parametri, come l'energia di attivazione, l'ordine di reazione o il contributo al processo totale. I parametri calcolati per il caso in esame sono elencati nella Tabella 2.
Sulla base di questi risultati, è possibile calcolare previsioni per profili di temperatura che non sono stati misurati in precedenza o che non sono nemmeno accessibili sperimentalmente.
Ciò è stato fatto per i due scenari seguenti:
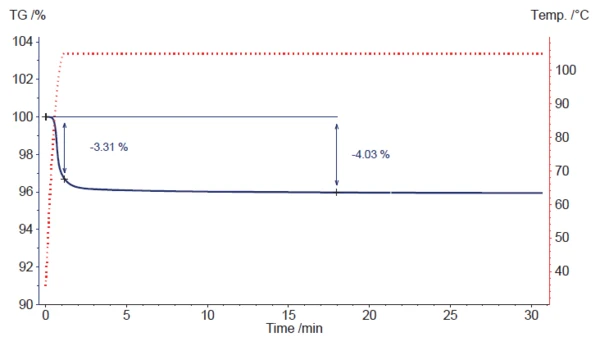
1. Il primo è una simulazione della perdita di classical processo di essiccazione in una camera di essiccazione impostata a 105°C. [3], [4]
selectPer simulare l'inserimento diretto del campione in una camera di essiccazione calda, è stata indicata una velocità di riscaldamento iniziale di 100 K/min, seguita da un segmento IsotermicoI test a temperatura controllata e costante sono detti isotermici.isotermico a 105°C (vedi fig. 3).
La perdita di massa inizia durante la fase di riscaldamento rapido, ma non può terminare completamente. Solo il 3,3% circa della perdita di massa avviene prima del passaggio al segmento IsotermicoI test a temperatura controllata e costante sono detti isotermici.isotermico. Dopo circa 18 minuti, si raggiunge una perdita di massa del 4,03%, che concorda con il valore del 4,02% riportato sul certificato di analisi dello stearato di magnesio utilizzato.
Tabella 2: Parametri cinetici formali del processo di disidratazione dello stearato di magnesio
| Parametri | A → B Fn | B →C Fn | C →D Fn |
|---|---|---|---|
| Energia di attivazione [kJ/mol] | 122.34 | 129.25 | 217.42 |
| Fattore preesponenziale log | 16.15 | 16.46 | 27.59 |
| Ordine di reazione | 0.853 | 0.948 | 3.007 |
| Contributo | 0.553 | 0.349 | 0.009 |
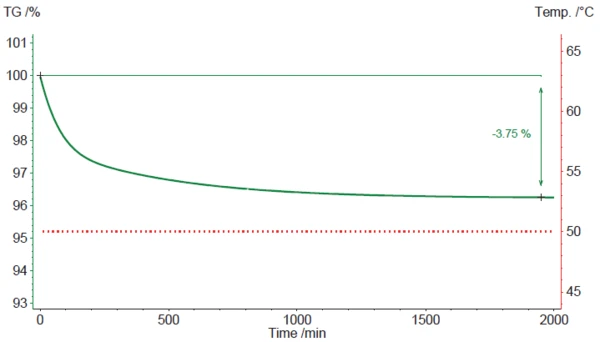
2. Il secondo scenario è una simulazione di un trattamento IsotermicoI test a temperatura controllata e costante sono detti isotermici.isotermico del campione di stearato di magnesio a 50°C (fig. 4).
In questo caso, la perdita di massa osservata inizia immediatamente e si protrae a lungo. Dopo circa 32 ore (1920 minuti), ammonta al 3,75%. Rimane solo lo 0,27% (basato su un valore di riferimento di perdita di massa del 4,02%; vedi sopra). Questo valore viene più o meno mantenuto anche se il tempo viene prolungato a 80 o 160 ore. Ciò suggerisce che lo stearato di magnesio tende a perdere la maggior parte - ma non tutta - la sua acqua (idrato) se viene conservato in condizioni asciutte e calde per un periodo di tempo più lungo. Per una completa disidratazione, tuttavia, una temperatura di 50°C non sembra essere sufficiente.
Conclusione
La valutazione cinetica attraverso l'applicazione di NETZSCH Kinetics Neo offre l'opportunità di determinare un modello matematico che descrive il comportamento sperimentale dei campioni durante il trattamento termico. Sebbene si tratti di una descrizione formale per scopi tecnici e di solito non rifletta l'intero meccanismo chimico alla base del processo, può fornire preziosi indizi su ciò che sta accadendo nel campione. Per quanto riguarda i processi di disidratazione, questo ci permette di determinare facilmente quale profilo di temperatura sembra essere più promettente - e tutto questo senza un laborioso approccio per tentativi ed errori.