Einleitung
Kommt Wasser in Berührung mit einer kristallinen Substanz, können verschiedene Arten von Wechselwirkungen auftreten: Die Wassermoleküle können einfach an der Oberfläche adsorbieren, kondensiertes flüssiges Wasser kann sich auf dem Festkörper absetzen (im Fall von Deliqueszenz oder Kapillarkondensation) oder das Wasser kann sogar in die Kristallstruktur eingebunden werden (Absorption) und stöchiometrische oder nichtstöchiometrische Hydrate bilden [1]. Bei der Aufheizung wiederum sind unterschiedliche Mengen an Energie erforderlich, um diese Wechselwirkungen zu überwinden und die gebildeten Bindungen zu brechen. Deshalb kommt es bei der Aufheizung eines Hydrats manchmal zu mehreren Massenverluststufen: Zunächst desorbieren die an der Oberfläche adsorbierten Wassermoleküle, gefolgt von stärker gebundenem Wasser.
Für die Konzeption eines Entwässerungsprozesses ist es deshalb sehr wichtig, die thermischen Eigenschaften der jeweiligen Probe zu kennen. Thermogravimetrische Analyse in Kombination mit einer kinetischen Auswertung ist hier äußerst hilfreich, da sie dazu beitragen kann, die Entwicklungszeit eines geeigneten Temperaturprogramms erheblich zu verkürzen.
Kombiniert man thermische Messungen mit Kopplungstechniken, wie z.B. TG oder STA, mit einem Gasanalysesystem wie FT-IR, dann lässt sich zusätzlich herausfinden, ob es sich bei dem freigesetzten Gas während der Aufheizung wirklich nur um Wasser handelt oder ob weitere flüchtige Bestandteile beteiligt sind.
Magnesiumstearat als Modellsubstanz –Experimenteller Teil
Magnesiumstearat ist einer der am häufigsten verwendeten Hilfsstoffe im pharmazeutischen Bereich. Es wird in der Regel als Schmiermittel eingesetzt, das festen Darreichungsformen wie Tabletten zugesetzt wird. Viele handelsübliche Magnesiumstearatqualitäten bestehen aus einer Mischung verschiedener Hydrate: Monohydrat (geordnet oder ungeordnet), Dihydrat und/oder Trihydrat [2].
Für die vorliegende Versuchsreihe wurden ca. 6,5 mg Magnesiumstearat-Pulver im Anlieferzustand mit einer NETZSCH TG 209 F1 mit Heizraten zwschen 2 K/min und 20 K/min aufgeheizt. Der komplette Satz an Messparametern ist in Tabelle 1 aufgeführt. Separate TG/FTIR-Messungen (hier nicht dargestellt) haben bestätigt, dass bis ca. 180 °C nur Wasser freigesetzt wurde.
Tabelle 1: Messparameter
Table 1: Measurement parameters
| Parameter | Magnesiumstearate |
|---|---|
| Probeneinwaage | Ca. 6.5 mg |
| Atmosphäre | Stickstoff |
| Tiegel | Al, offen |
| Temperaturprogramm | RT bis 180°C |
| Heizraten | 2, 5, 10 and 20 K/min |
| Durchflussrate | 40 ml/min |
| Probenhalter | TG, Typ P |
Ergebnisse und Diskussion
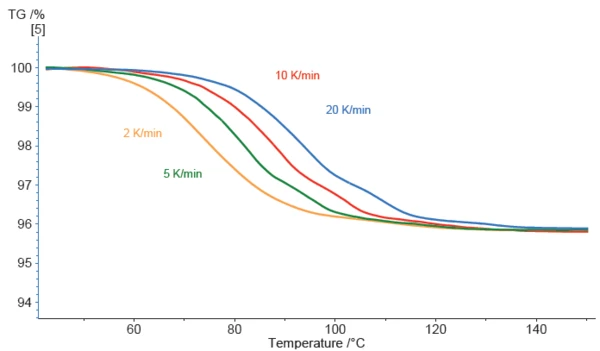
Der beobachtete Massenverlust der Magnesiumstearat-Probe setzt ziemlich früh ein. In der mit 2 K/min erstellten Kurve ist bereits bei etwa 50 °C eine Abweichung sichtbar (Abbildung 1).
Je höher die verwendete Heizrate, desto mehr verschieben sich die Kurven zu höheren Temperaturen, was für kinetische Effekte charakteristisch ist. Auch werden die Kurven mit höheren Heizraten strukturierter. In der blauen Kurve (Messung durchgeführt mit 20 K/min) können deutlich drei Massenverluststufen detektiert werden. Dies zeigt, dass eine Erniedrigung der Heizrate nicht immer zu einer besseren Trennung der überlagerten Effekte führt – manchmal ist das Gegenteil der Fall, wie im vorliegenden Beispiel. Die Kinetik hinter den Massenverlusteffekten ist entscheidend. Um mehr über die Kinetik hinter den Massenverlusteffekten zu erfahren, wurde anschließend die Software NETZSCH-Kinetics Neo eingesetzt. Mit dieser war es möglich, die experimentellen Daten durch Anwendung eines dreistufigen Folgemodells von Reaktionen n-ter Ordnung (t:FnFnFn, siehe Abbildung 2) gut anzupassen.
A → B → C → D
Der entsprechende Korrelationskoeffizient R2, ein Zeichen für die Anpassungsqualität, wurde mit 0,99993 ermittelt.
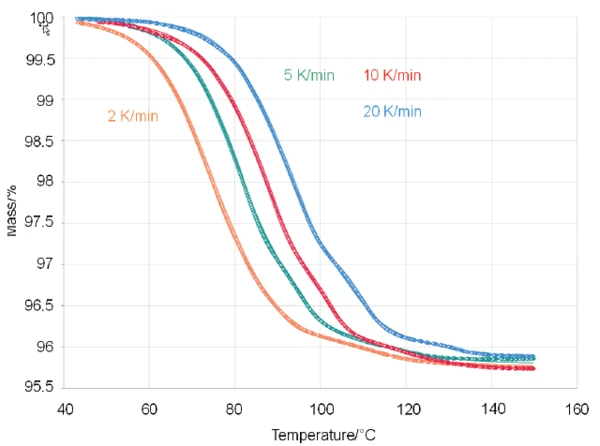
Kinetics Neo ist eine formale Kinetik-Software, mit der unterschiedliche Arten temperaturabhängiger chemischer Prozesse analyisiert werden können, unabhängig davon, ob sie – unter anderem – mit einer Massenänderung, Längenänderung oder Enthalpieänderung verbunden sind. Kinetics Neo kann auf der Grundlage von modellfreien und modellbasierten Methoden arbeiten. Mit dem modellbasierten kinetischen Ansatz erhält man Informationen über jede Reaktionsstufe zusammen mit den zugehörigen Parametern wie Aktivierungsenergie, Reaktionsordnung oder den Beitrag zum gesamten Prozess. Die berechneten Parameter für die vorliegende Untersuchung sind in Tabelle 2 aufgeführt.
Auf der Grundlage dieser Erkenntnisse lassen sich Vorhersagen für Temperaturprofile berechnen, die zuvor nicht gemessen wurden oder sogar experimentell nicht zugänglich sind.
Dies wurde für folgende zwei Szenarien durchgeführt:
1. Das erste ist eine Simulation des klassischen Trocknungsvorgangs in einer Trockenkammer, die auf 105 °C eingestellt wurde [3], [4].
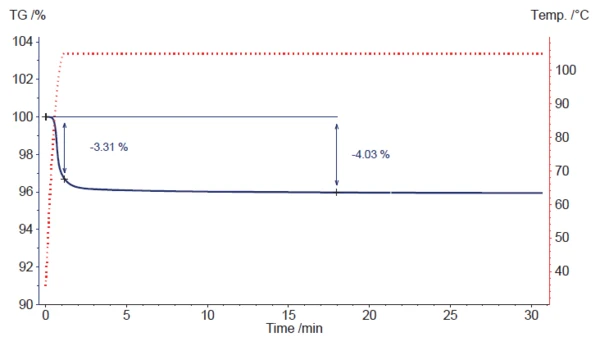
Um das direkte Einlegen der Proben in eine heiße Trockenkammer zu simulieren, wurde als anfängliche Heizrate 100 K/min gewählt, gefolgt von einem Isothermsegment bei 105 °C (siehe Abbildung 3).
Der Massenverlust setzt während der schnellen Aufheizphase ein, kann jedoch in der dynamischen Phase nicht vollständig abgeschlossen werden.
Nur ca. 3,3 % der Masse ändert sich vor dem Wechsel zum isothermen Segment. Nach ca. 18 Minuten ist ein Massenverlust von 4,03 % erreicht, was gut mit dem auf dem Analysezertifikat des verwendeten Magnesiumstearats angegebenen Wert von 4,02 % übereinstimmt.
Tabelle 2: Formalkinetische Parameter des Entwässerungsprozesses von Magnesiumstearat
Table 2: Formal kinetic parameters of the dehydration process of magnesium stearate
| Parameter | A → B Fn | B →C Fn | C →D Fn |
|---|---|---|---|
| Aktivierungsenergie [kJ/mol] | 122.34 | 129.25 | 217.42 |
| Log Präexponential-Faktor | 16.15 | 16.46 | 27.59 |
| Reaktionsordnung | 0.853 | 0.948 | 3.007 |
| Beitrag | 0.553 | 0.349 | 0.009 |
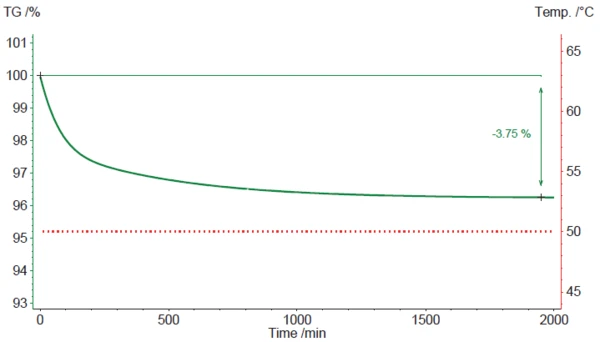
2. Das zweite Szenario ist die Simulation einer isothermen Behandlung der Magnesiumstearat-Probe bei 50 °C (Abbildung 4).
In diesem Fall setzt der beobachtete Massenverlust sofort ein und zieht sich über einen langen Zeitraum hin. ach ca. 32 Stunden (1920 Minuten) beläuft er sich auf 3,75 %. Es verbleiben lediglich 0,27 % (basierend auf einem Referenzwert des Massenverlustes von 4,02 %, siehe oben). Dieser Wert wird dann auch mehr oder weniger beibehalten, wenn die Zeit auf 80 oder 160 Stunden verlängert wird. Dies deutet darauf hin, dass Magnesiumstearat die Tendenz aufweist, das meiste, jedoch nicht das gesamte (Hydrat-)Wasser zu verlieren, wenn es über einen längeren Zeitraum an einem trockenen und heißen Ort gelagert wird. Für eine vollständige Dehydratisierung scheint eine Temperatur von 50 °C jedoch nicht ausreichend zu sein.
Zusammenfassung
Die kinetische Auswertung mit NETZSCH-Kinetics Neo bietet die Möglichkeit, ein mathematisches Modell zu ermitteln, das das experimentelle Verhalten von Proben während einer thermischen Behandlung erlaubt. Obwohl es sich dabei um eine formale Beschreibung für technische Zwecke handelt und in der Regel nicht den vollständigen chemischen Mechanismus hinter dem Prozess widerspiegelt, erhält man wertvolle Hinweise, was in der Probe vor sich geht. Auf diese Weise lässt sich bei Entwässerungsvorgängen einfach herausfinden, welches Temperaturprofil vielversprechender ist – und das ohne aufwändiges Ausprobieren.