مقدمة
في مجال الصيدلة، لا يكاد يوجد أي عنصر نشط كُتب عنه أكثر مما كُتب عن حمض أسيتيل الساليسيليك (أو ASA اختصارًا؛ وفي البلدان الناطقة بالإنجليزية غالبًا ما يُستخدم الاسم التجاري Aspirin™ كمرادف له). وقد بدأت قصة نجاحه في نهاية القرن التاسع عشر عندما قام الدكتور فيليكس هوفمان بتصنيع هذه المادة في مختبرات باير لأول مرة بدون شوائب. في الوقت الحاضر، لا يزال أحد أكثر المستحضرات الصيدلانية شيوعًا المستخدمة في نطاق علاجي واسع. وهو ينتمي إلى مجموعة العقاقير غير الستيرويدية المضادة للالتهابات (NSAIDs) ويستخدم لعلاج الألم والحمى والالتهابات. بالإضافة إلى ذلك، يُستخدم للوقاية من تكرار النوبة القلبية أو السكتة الدماغية لدى المرضى المعرضين لخطر الإصابة. في عام 1977، تمت إضافة ASA كمسكن إلى "قائمة الأدوية الأساسية" لمنظمة الصحة العالمية (منظمة الصحة العالمية) [1].
هذه هي المذكرة الثانية من أربع مذكرات تطبيقية تدرس بمزيد من التفصيل السلوك الحراري لحمض أسيتيل الساليسيليك: التحلل في أجواء غازية مختلفة، وحركية التحلل، وأنواع الغازات الناتجة [2] [3] [4].
التحليل الحركي للبيانات التحليلية الحرارية
من خلال بيانات القياس الخاصة بطرق التحليل الحراري، يمكن الحصول على معلومات حول فقدان الكتلة بسبب التحلل أو الانحلال الحراري أو الاحتراق، أو حول التغيرات النشطة مثل الذوبان أو التبلور أو أيضًا حول التغيرات في أبعاد العينة بسبب التمدد الحراري أو التلبيد، على سبيل المثال، في المواد الخزفية. ومع ذلك، مع هذه البيانات، لا يتم استخدام محتوى المعلومات بشكل شامل. بمساعدة تحليل حركي أكثر شمولاً، من الممكن أيضًا الحصول على معلومات حول المسار الزمني للتفاعل في درجات حرارة مختلفة، أي معدل التفاعل. إذا كان من الممكن وصف مسار التفاعل بشكل جيد بما فيه الكفاية بمساعدة نظام من المعادلات الرياضية، فمن الممكن أيضًا إجراء تنبؤات حول مسار التفاعل الذي لا يمكن الوصول إليه تجريبيًا أو بصعوبة فقط. وهذا بدوره يمكن استخدامه لتحسين العمليات أو للتنبؤ بعمر الخدمة أو الاستقرار التأكسدي أو سلوك تقادم المواد والمنتجات.
النتائج والمناقشة
من أجل فهم السلوك الحراري لحمض أسيتيل الساليسيليك بشكل أفضل، تم تنفيذ نهج حركي في محاولة لإيجاد نظام من المعادلات الرياضية لوصف البيانات التجريبية. تمت دراسة السلوك الحراري باستخدام جهاز NETZSCH TG 209 F1 Libra® وتطبيق شروط القياس الملخصة في الجدول 1. يتطلب النهج الحركي سلسلة من ثلاثة معدلات تسخين مختلفة على الأقل من أجل وصف الارتباط بين الزمن ودرجة الحرارة، وهو الهدف الرئيسي للتقييمات الحركية بشكل عام.
الجدول 1: معلمات قياس TGA
| المعلمات | حمض أسيتيل الساليسيليك |
|---|---|
| كتلة العينة [مجم] | 4.982 │ 5.014 │ 5.053 |
| الغلاف الجوي | الأرجون |
| بوتقة | Al2O3، 85 ميكرولتر، مفتوح |
| برنامج درجة الحرارة | RT - 450 درجة مئوية |
| معدلات التسخين [كلفن/دقيقة] | 3 │ 10 │ 30 |
| معدل تدفق الغاز [مل/دقيقة] | 40 |
| حامل العينة | TGA |
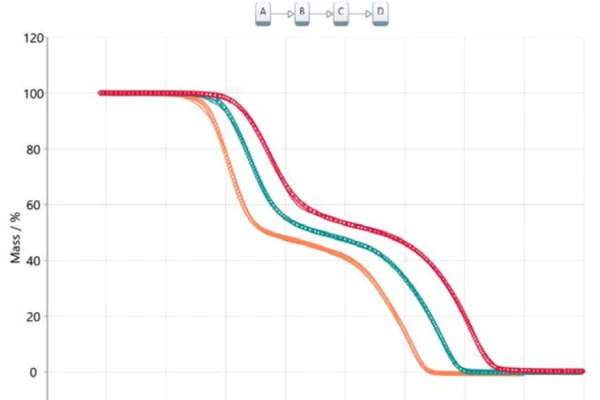
يوضح الشكل 1 النتائج كما تم الحصول عليها في برنامج التحليل NETZSCH Proteus®. يكشف قياس الثقل الحراري بين 100 درجة مئوية و400 درجة مئوية عن خطوتين رئيسيتين لفقدان الكتلة للتحلل الحراري لحمض أسيتيل الساليسيليك. تنتقل منحنيات TGA إلى درجات حرارة أعلى مع زيادة معدل التسخين. يشير التحول المتوازي إلى حد كبير، بالإضافة إلى الكتلة النهائية المتطابقة تقريبًا، إلى أن معدل التسخين نفسه لا يغير آلية التفاعل بشكل كبير. وهذا أيضًا مؤشر واضح على أن آلية التفاعل ليست معقدة للغاية في هذه الحالة. من ناحية أخرى، يمكن أن نرى بوضوح أن خطوات فقدان الكتلة ليست منفصلة تمامًا. لا توجد هضبة مرئية تحدد بوضوح نهاية خطوة فقدان الكتلة الأولى أو بداية خطوة فقدان الكتلة الثانية. وكما تأكد من خلال تقنيات الاقتران مثل TGA-FT-IR أو TGA-MS أو TGA-GC-MS، يحدث كل من الانحلال الحراري والتبخر في وقت واحد [2] [4] [5].
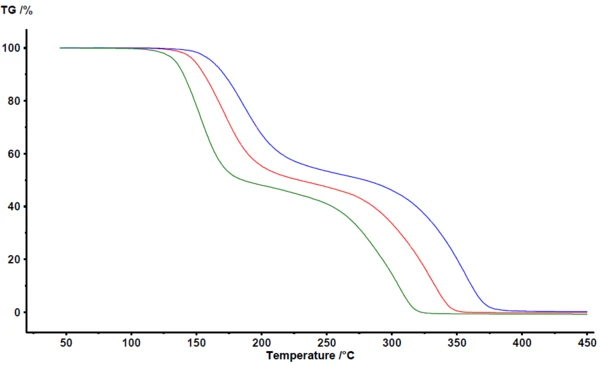
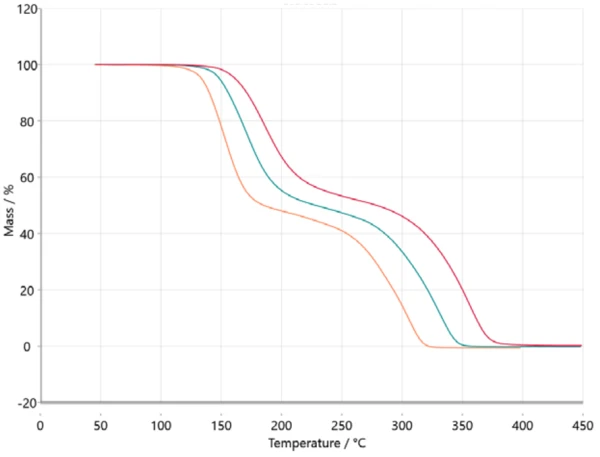
للتحليل الحركي، يتم نقل البيانات المقاسة في برنامج NETZSCH Kinetics Neo عبر ASCII. البيانات المستوردة موضحة في الشكل 2.
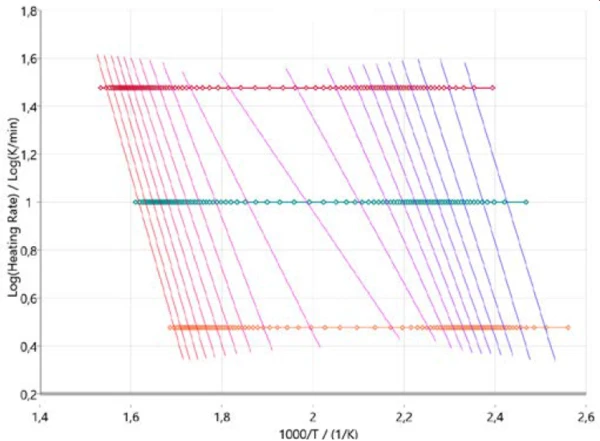
من أجل الحصول على فكرة أولية عن آلية التفاعل، من المفيد بدء التحليل الحركي بما يسمى بالنهج الخالي من النماذج. يوضح الشكل 3 النتائج وفقًا لطريقة Ozawa-Flynn-Wall، حيث يتم رسم لوغاريتم معدل التسخين مقابل درجة الحرارة العكسية. لا يأخذ هذا النهج في الاعتبار جميع نقاط البيانات المقاسة فحسب، بل يقدم أيضًا معلومات حول التغير في طاقة التنشيط وكذلك العامل الأسي المسبق على مدار مسار التفاعل بأكمله (درجة التحويل). وهذا يساعد بشكل خاص في التفاعلات متعددة الخطوات. يصف المخطط تطور التفاعل (من اليمين إلى اليسار) لمعدلات التسخين الثلاثة (الرموز الأفقية). وتربط الخطوط الرأسية تقريبًا نفس درجة التحويل لكل معدل تسخين ولذلك تسمى خطوط التحويل المتساوي.
وتكون هذه الخطوط التحويلية المتساوية متوازية إلى حد ما في نطاقات خطي التحلل الحراري الرئيسيين في بداية ونهاية العملية بأكملها. عند حوالي 50% من التحويل، تُظهر خطوط التحويل المتساوي ميلًا مختلفًا يشير إلى تغير في آلية التفاعل. في تلك المرحلة من التفاعل، يحدث الانحلال الحراري والتبخر في وقت واحد كما ذكرنا سابقًا [2] [4] [5].
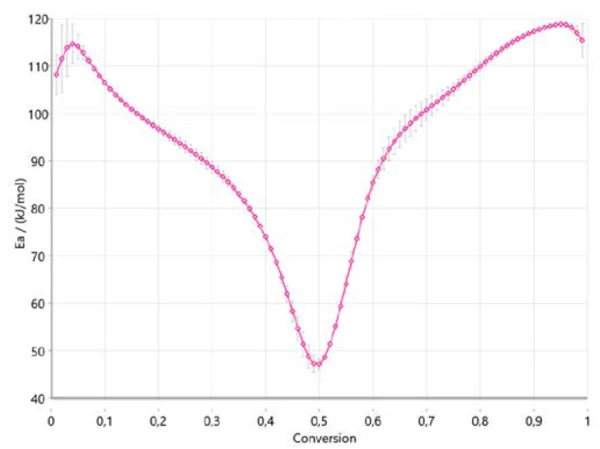
ويوضح الشكل 4 كيف تتغير طاقة التنشيط مع تقدم التفاعل وفقًا لأوزاوا-فلين-وول. وهذه معلومات مهمة للغاية لأنها تشير بالفعل إلى ثلاثة نطاقات للعملية بأكملها، حيث تبلغ طاقة التنشيط حوالي 110 كيلوجول/مول في البداية، وحوالي 40 كيلوجول/مول بين 40 و50% من التحويل، وحوالي 120 كيلوجول/مول في نهاية التفاعل. يؤكد التغير في طاقة التنشيط مع درجة التحويل وجود آلية تفاعل متعددة الخطوات. ترتبط القيم التي تم الحصول عليها ارتباطًا جيدًا بالنتائج المنشورة في الأدبيات [6].
يؤدي نقل هذه المعلومات إلى تحليل قائم على النموذج إلى نموذج ثلاثي متتابع من ثلاث خطوات (t:FnFnFnFn)، حيث يمثل A المادة الأولية (حمض أسيتيل الساليسيليك)، وB وC هما المادتان الوسيطة المعروفة من الأدبيات [6، 7] وD هو المنتج النهائي. في هذه الحالة، لا يمثل المنتج النهائي، بالطبع، مادة حقيقية ولكنه يصف نهاية التفاعل أو التحويل بنسبة 100% لأن الكتلة المتبقية لجميع المنحنيات الحرارية الثلاثة هي صفر. جميع المنتجات المتكونة غازية وبالتالي تتبخر من البوتقة أثناء التسخين إلى درجة الحرارة النهائية. ويوضح الشكل 5 نتيجة هذا النهج القائم على النموذج. تُعرض البيانات المقاسة على شكل رموز، وتُعرض نتائج النموذج المحسوب ثلاثي الخطوات المتتالية على شكل خطوط متصلة مع الألوان المتعلقة بمعدلات التسخين المختلفة. يتطابق النموذج المحسوب بشكل مثالي تقريبًا مع البيانات التجريبية، وهو ما يؤكده في النهاية معامل الارتباط البالغ 0.99986.
يلخص الجدول 2 المعلمات المحسوبة عامل ما قبل التنشيط وطاقة التنشيط ورتبة التفاعل لكل خطوة تفاعل على حدة. تتفق جميع قيم طاقة التنشيط بشكل جيد مع القيم التي اقترحها نهج Ozawa-Flynn-Wall وكذلك مع القيم المذكورة في الأدبيات [6]. وتبلغ مساهمة كل خطوة من خطوات التفاعل الثلاث 40.3% و13.6% و46.1% على التوالي، وهو ما يتوافق جيدًا مع خطوات فقدان الكتلة المقدمة.
الجدول 2: البارامترات الناتجة عن نهج قاعدة النموذج باستخدام نموذج ثلاثي الخطوات المتتالية من الرتبة ن
| المعلمة | الخطوةالأولى (Fn) | الخطوةالثانية (Fn) | الخطوةالثالثة (Fn) |
|---|---|---|---|
| لوغاريتم (PreExp) | 9.88 | 0.88 | 8.02 |
| EA (كيلو جول/مول) | 101.3 | 30.7 | 116.6 |
| ترتيب التفاعل | 1.01 | 0.91 | 0.77 |
| المساهمة (%) | 40.3 | 13.6 | 46.1 |
الخاتمة
إن آلية التحلل الحراري لحمض أسيتيل الساليسيليك المقترحة في الأدبيات هي آلية من خطوتين مع تبخر متزامن للمركبات الوسيطة [6]. وقد وجد غريغوري وآخرون أن حمض الأسيتيك هو المركب الرئيسي الذي يتم إطلاقه خلال الخطوة الأولى لفقدان الكتلة. وعلاوة على ذلك، يقترحون آلية الانحلال الحراري التي تشكل مجموعة متنوعة من القِلَّة (oligomers)، كما هو مبين بوحدات الكتلة الذرية (amu) المكتشفة باستخدام قياس الطيف الكتلي (MS) [6][7]. وبالإضافة إلى تأكيد أن المنتجات الغازية الرئيسية هي حمض الأسيتيك وحمض الساليسيليك والفينول وحمض أسيتيل الساليسيليك، تم استخدام تقنية اقتران أكثر تطورًا TGA-GC-MS من أجل فصل وتحديد المزيد من منتجات الانحلال الحراري [2]. أبلغ جميع المؤلفين عن تراكب الانحلال الحراري والتبخر بين 40% و60% من تقدم التفاعل.
في العمل الحالي، كان من الممكن تطبيق هذه النتائج في نهج حركي قائم على النموذج مع نموذج ثلاثي الخطوات متتالية من الدرجة التاسعة. تم تأكيد الارتباط الجيد بين البيانات التجريبية والنموذج الرياضي من خلال معامل الارتباط 0.99986. تتفق قيم طاقة التنشيط، على سبيل المثال، بشكل جيد مع القيم المذكورة في الأدبيات. ومع ذلك، فإن النهج القائم على نموذج نموذج ثلاثي الخطوات المتتالية المقدم هنا هو بالتأكيد خطوة أبعد من النهج الخالية من النماذج التحويلية المتساوية القائمة على أوزاوا-فلين-وول أو غيرها [6]، من بين أمور أخرى، حيث تتوفر البيانات الحركية بشكل مستقل لكل خطوة تفاعل على حدة.