Wprowadzenie
W farmacji nie ma prawie żadnego aktywnego składnika, o którym napisano by więcej niż o kwasie acetylosalicylowym (lub w skrócie ASA; w krajach anglojęzycznych nawet nazwa marki Aspirin™ jest często używana jako synonim). Historia jego sukcesu rozpoczęła się pod koniec XIX wieku, kiedy dr Felix Hoffmann po raz pierwszy zsyntetyzował tę substancję w laboratoriach BAYER bez zanieczyszczeń. Obecnie jest to nadal jeden z najpopularniejszych farmaceutyków stosowanych w szerokim zakresie terapeutycznym. Należy do grupy niesteroidowych leków przeciwzapalnych (NLPZ) i jest wskazany w leczeniu bólu, gorączki i stanów zapalnych. Ponadto jest stosowany w zapobieganiu nawrotom zawału serca lub udaru mózgu u pacjentów z grupy wysokiego ryzyka. W 1977 r. ASA został dodany jako środek przeciwbólowy do "listy podstawowych leków" WHO (Światowej Organizacji Zdrowia) [1].
Jest to druga z czterech not aplikacyjnych, które bardziej szczegółowo analizują zachowanie termiczne kwasu acetylosalicylowego: Rozkład w różnych atmosferach gazowych, kinetyka rozkładu i powstające gatunki gazów [2] [3] [4].
Analiza kinetyczna danych termoanalitycznych
Dzięki danym pomiarowym z metod termoanalitycznych można uzyskać informacje o utracie masy w wyniku rozkładu, pirolizy lub spalania, o zmianach energetycznych, takich jakTemperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo). topnienie lub KrystalizacjaKrystalizacja to fizyczny proces twardnienia podczas tworzenia i wzrostu kryształów. Podczas tego procesu uwalniane jest ciepło krystalizacji.krystalizacja, a także o zmianach wymiarów próbki w wyniku rozszerzalności cieplnej lub spiekania, na przykład w materiałach ceramicznych. W przypadku tych stwierdzeń zawartość informacji nie jest jednak wykorzystywana w sposób wyczerpujący. Za pomocą bardziej kompleksowej analizy kinetycznej możliwe jest również uzyskanie informacji o terminowym przebiegu reakcji w różnych temperaturach, tj. szybkości reakcji. Jeśli przebieg reakcji można wystarczająco dobrze opisać za pomocą układu równań matematycznych, możliwe jest również przewidywanie przebiegu reakcji, które nie są dostępne eksperymentalnie lub tylko z trudnością. To z kolei można wykorzystać do optymalizacji procesów lub przewidywania żywotności, stabilności oksydacyjnej lub starzenia się materiałów i produktów.
Wyniki i dyskusja
Aby lepiej zrozumieć zachowanie termiczne kwasu acetylosalicylowego, zastosowano podejście kinetyczne, próbując znaleźć układ równań matematycznych do opisu danych eksperymentalnych. Zachowanie termiczne badano przy użyciu urządzenia NETZSCH TG 209 F1 Libra® i stosując warunki pomiaru podsumowane w tabeli 1. Podejście kinetyczne wymaga serii co najmniej trzech różnych szybkości ogrzewania w celu opisania korelacji czas-temperatura, co jest głównym celem ocen kinetycznych w ogóle.
Tabela 1: Parametry pomiaru TGA
| Parametry | Kwas acetylosalicylowy |
|---|---|
| Masa próbki [mg] | 4.982 │ 5.014 │ 5.053 |
| Atmosfera | Argon |
| Tygiel | Al2O3, 85 μl, otwarty |
| Program temperatury | RT - 450°C |
| Szybkość ogrzewania [K/min] | 3 │ 10 │ 30 |
| Natężenie przepływu gazu [ml/min] | 40 |
| Uchwyt próbki | TGA |
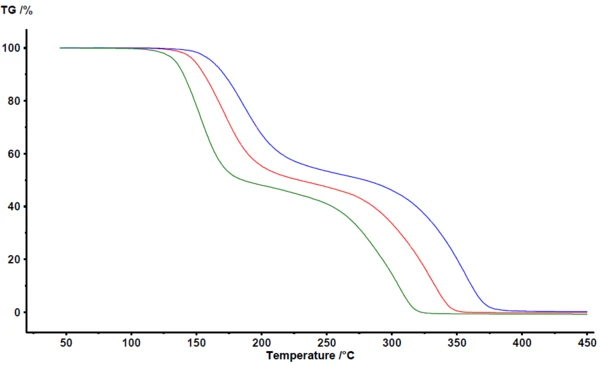
Rysunek 1 przedstawia wyniki uzyskane w oprogramowaniu analitycznym NETZSCH Proteus® . Pomiędzy 100°C a 400°C termograwimetria wykrywa dwa główne etapy utraty masy podczas pirolizy kwasu acetylosalicylowego. Krzywe TGA przesuwają się do wyższych temperatur wraz ze wzrostem szybkości ogrzewania. Przesunięcie largely równoległe, jak również prawie identyczna masa końcowa, wskazują, że sama szybkość ogrzewania nie zmienia znacząco mechanizmu reakcji. Jest to również wyraźne wskazanie, że mechanizm reakcji nie jest w tym przypadku bardzo złożony. Z drugiej strony wyraźnie widać, że etapy utraty masy nie są idealnie rozdzielone. Nie ma widocznego plateau wyraźnie definiującego koniec pierwszego etapu utraty masy lub początek drugiego etapu utraty masy. Jak potwierdzają techniki sprzęgania, takie jak TGA-FT-IR, TGA-MS lub TGA-GC-MS, zarówno PirolizaPiroliza to termiczny rozkład związków organicznych w atmosferze obojętnej.piroliza, jak i OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie zachodzą jednocześnie [2][4][5].
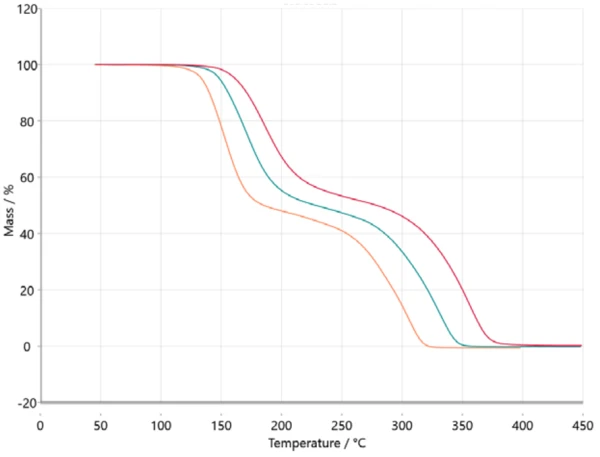
Do analizy kinetycznej dane pomiarowe są przesyłane do oprogramowania NETZSCH Kinetics Neo za pośrednictwem ASCII. Zaimportowane dane przedstawiono na rysunku 2.
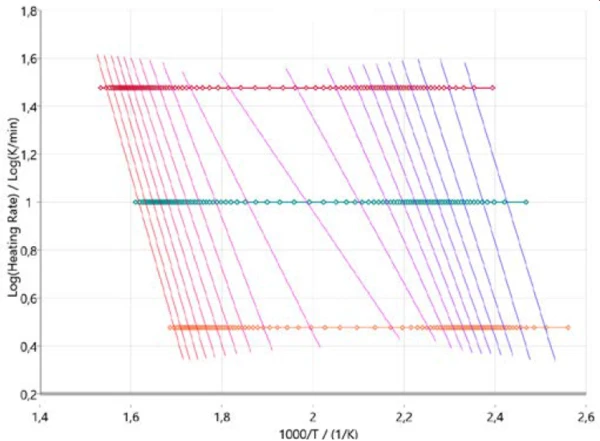
Aby uzyskać wstępne wyobrażenie o mechanizmie reakcji, warto rozpocząć analizę kinetyczną od tak zwanych podejść bezmodelowych. Rysunek 3 przedstawia wyniki zgodnie z metodą Ozawy-Flynna-Walla, w której logarytm szybkości ogrzewania jest wykreślany względem odwrotności temperatury. Podejście to nie tylko uwzględnia wszystkie zmierzone punkty danych, ale także dostarcza informacji o zmianie energii aktywacji, a także współczynnika przedwykładniczego w całym przebiegu reakcji (stopień konwersji). Jest to szczególnie pomocne w przypadku reakcji wieloetapowych. Wykres opisuje postęp reakcji (od prawej do lewej) dla wszystkich trzech szybkości ogrzewania (symbole poziome). Prawie pionowe linie łączą ten sam stopień konwersji dla każdej szybkości ogrzewania i dlatego nazywane są liniami izokonwersji.
Te linie izokonwersji są mniej więcej równoległe w zakresach dla dwóch głównych etapów pirolizy na początku i na końcu całego procesu. Przy około 50% konwersji linie izokonwersji wykazują inne nachylenie, co wskazuje na zmianę mechanizmu reakcji. Na tym etapie reakcji PirolizaPiroliza to termiczny rozkład związków organicznych w atmosferze obojętnej.piroliza i OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie zachodzą jednocześnie, jak wspomniano wcześniej [2][4][5].
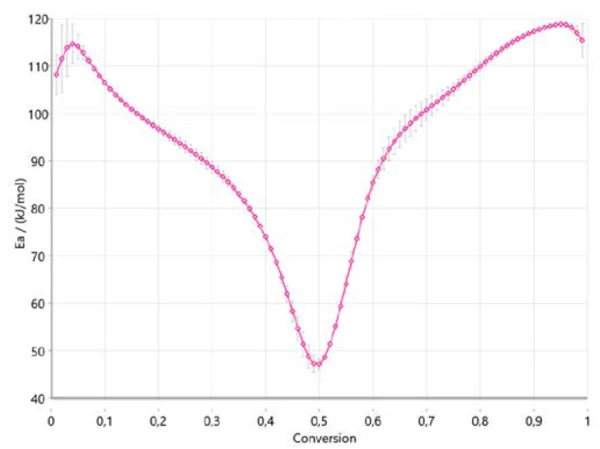
Rysunek 4 pokazuje, jak energia aktywacji zmienia się wraz z postępem reakcji zgodnie z Ozawa-Flynn-Wall. Jest to bardzo ważna informacja, ponieważ wskazuje już trzy zakresy dla całego procesu, z energią aktywacji około 110 kJ/mol na początku, około 40 kJ/mol między 40% a 50% konwersji i około 120 kJ/mol na końcu reakcji. Zmiana energii aktywacji wraz ze stopniem konwersji potwierdza wieloetapowy mechanizm reakcji. Uzyskane wartości są w dobrej korelacji z wynikami opublikowanymi w literaturze [6].
Przeniesienie tych informacji do analizy opartej na modelu prowadzi do trójstopniowego modelu sekwencyjnego (t:FnFnFn), gdzie A reprezentuje materiał wyjściowy (kwas acetylosalicylowy), B i C są półproduktami znanymi z literatury [6, 7], a D jest produktem końcowym. W tym przypadku produkt końcowy nie jest oczywiście tak naprawdę substancją, ale opisuje koniec reakcji lub 100% konwersję, ponieważ masa resztkowa dla wszystkich trzech krzywych termograwimetrycznych wynosi zero. Wszystkie powstałe produkty są gazowe i dlatego odparowały z tygla podczas ogrzewania do temperatury końcowej. Rysunek 5 przedstawia wynik tego podejścia opartego na modelu. Dane pomiarowe przedstawiono jako symbole, a wyniki dla obliczonego trzystopniowego modelu przedstawiono jako linie ciągłe z kolorami związanymi z różnymi szybkościami ogrzewania. Obliczony model prawie idealnie pasuje do danych eksperymentalnych, co ostatecznie potwierdza współczynnik korelacji wynoszący 0,99986.
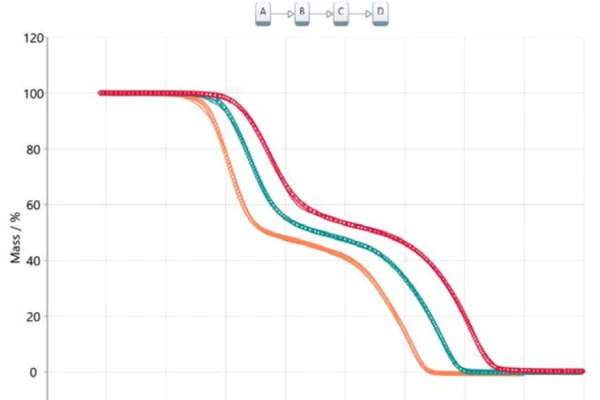
Obliczone parametry współczynnika preekspotencjalnego, energii aktywacji i rzędu reakcji podsumowano w tabeli 2 dla każdego etapu reakcji. Wszystkie wartości energii aktywacji są zgodne z wartościami sugerowanymi przez metodę Ozawy-Flynna-Walla, jak również z wartościami podanymi w literaturze [6]. Udział każdego z trzech etapów reakcji wynosi odpowiednio 40,3%, 13,6% i 46,1%, co dobrze koreluje z przedstawionymi etapami utraty masy.
Tabela 2: Parametry wynikające z podejścia opartego na modelu przy użyciu trójstopniowego kolejnego modelu n-tego rzędu
| Parametr | 1. krok (Fn) | 2. krok (Fn) | 3. krok (Fn) |
|---|---|---|---|
| Log (PreExp) | 9.88 | 0.88 | 8.02 |
| EA (kJ/mol) | 101.3 | 30.7 | 116.6 |
| Kolejność reakcji | 1.01 | 0.91 | 0.77 |
| Wkład (%) | 40.3 | 13.6 | 46.1 |
Wnioski
Mechanizm pirolizy kwasu acetylosalicylowego sugerowany w literaturze to mechanizm dwuetapowy z jednoczesnym odparowaniem związków pośrednich [6]. Gregory i in. stwierdzili, że kwas octowy jest głównym związkiem uwalnianym podczas pierwszego etapu utraty masy. Ponadto sugerują oni mechanizm pirolizy tworzący różnorodne oligomery, na co wskazują atomowe jednostki masy (amu) wykryte za pomocą spektrometrii mas (MS) [6][7]. Wraz z potwierdzeniem, że głównymi produktami gazowymi są kwas octowy, kwas salicylowy, fenol i kwas acetylosalicylowy, zastosowano jeszcze bardziej zaawansowaną technikę sprzęgania TGA-GC-MS w celu oddzielenia i identyfikacji dalszych produktów pirolizy [2]. Wszyscy autorzy donoszą o superpozycji pirolizy i odparowania między 40% a 60% postępu reakcji.
W niniejszej pracy możliwe było zaimplementowanie tych wyników do podejścia kinetycznego opartego na modelu z trzystopniowym kolejnym modelem n-tego rzędu. Dobrą korelację między danymi eksperymentalnymi a modelem matematycznym potwierdza współczynnik korelacji wynoszący 0,99986. Na przykład wartości energii aktywacji są zgodne z wartościami podanymi w literaturze. Niemniej jednak, wprowadzone tutaj podejście oparte na modelu trzech kolejnych kroków jest z pewnością krokiem poza izokonwersyjnymi podejściami bez modelu opartymi na Ozawa-Flynn-Wall lub innych [6], między innymi, ponieważ dane kinetyczne są dostępne niezależnie dla każdego etapu reakcji.