مقدمة
يمكن أن تؤدي المعالجة الحرارية للمواد المختلفة إلى إطلاق الأمونيا، التي لها رائحة عدوانية وقد تهاجم الجهاز القصبي. يمكن أن ينجم إطلاق الأمونيا عن مجموعة متنوعة من العمليات المختلفة. وتتراوح هذه العمليات من التحلل الحراري للأملاح إلى الأبخرة الناتجة عن حرق التبغ، ومن التحلل الحراري للبوليمرات مثل البولي أميدات (PA) وتصنيع الرغاوي البلاستيكية التي تتطلب عوامل نفخ. ومن المنتجات المعروفة من الفئة الأخيرة حصائر اليوغا. يمكن أن يؤدي إطلاق الأمونيا إلى تكوين غبار ناعم عن طريق التفاعل مع حمض الكبريتيك وحمض النيتريك عندما تتكون الأملاح. وفي البيئة، يمكن أن يؤدي إطلاق الأمونيا إلى تحمض التربة. أحد المصادر الرئيسية للأمونيا في البيئة هو الزراعة، وخاصةً التسميد بالأسمدة المعدنية المحتوية على الروث والنيتروجين.
ولهذا السبب، كان القياس الكمي للأمونيا المنطلقة مهمًا في العديد من التطبيقات. يمكن الكشف عن إطلاق الأمونيا المعتمد على درجة الحرارة بسهولة عن طريق اقتران TGA-FT-الأشعة تحت الحمراء. ولتحديد كمية الأمونيا المنطلقة، من الضروري وجود منحنى معايرة بتركيز معروف من الأمونيا. والمركب المناسب لذلك هو بيكربونات الأمونيوم، لأنه يطلق الأمونيا بنسبة متكافئة بالإضافة إلى إطلاق الماء وثاني أكسيد الكربون؛ انظر المعادلة (1). يتم إنتاج مركبات غازية فقط:
(1) nh4hco3->nh3 + h2o+ co2
كيفية توليد منحنى المعايرة
استُخدم جهاز NETZSCH PERSEUS® TG 209 F1 Libra® لإجراء هذه الدراسة. وأدى تسخين بيكربونات الأمونيوم إلى تحلل كامل عند 200 درجة مئوية، مع وجود ذروة في معدل فقدان الكتلة عند 127 درجة مئوية (استنادًا إلى ظروف القياس في الجدول 1).
الجدول 1: شروط القياس لتوليد منحنى المعايرة
| المعلمة | NH4HCO3 | |||
| برنامج درجة الحرارة | RT - 200 درجة مئوية، 5 كلفن/دقيقة | |||
| معدل التدفق | 40 مل/دقيقة | |||
| حامل العينة | حامل العينة القياسي | |||
| جو الغاز | النيتروجين | |||
| بوتقة | Al2O3 (85 ميكرولتر) مفتوحة | |||
| كتلة العينة | 5.31 مجم | 10.16 مجم | 15.01 مجم | 20.50 مجم |
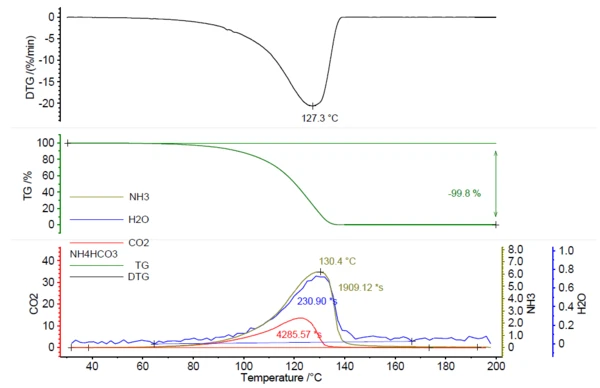
وبالارتباط مع فقدان الكتلة، تم اكتشاف إطلاق الغازات النشطة بالأشعة تحت الحمراء؛ انظر الشكل 1.
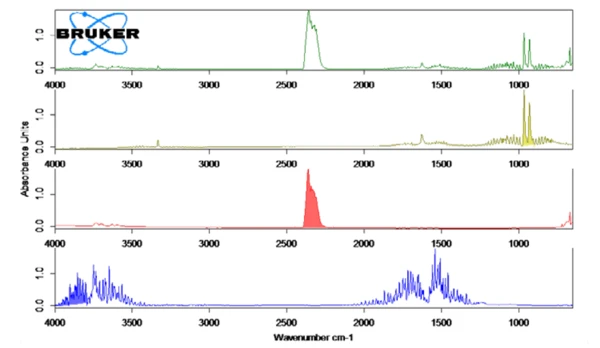
يُظهر الشكل 2 طيف الأشعة تحت الحمراء بالأشعة تحت الحمراء المقيسة عند درجة حرارة 130 درجة مئوية (أخضر) في ارتباط مع أطياف مكتبة الأمونيا (زيتون) والماء (أزرق) وثاني أكسيد الكربون (أحمر). تم رسم الإطلاق المعتمد على درجة الحرارة لهذه المركبات على شكل آثار في الشكل 1. تم إنشاء هذه الآثار من خلال تكامل المناطق الملونة (انظر الشكل 2) من أطياف الأشعة تحت الحمراء FT-IR لكل مركب على نطاق درجة الحرارة بالكامل. كانت هذه المناطق من أطياف الأشعة تحت الحمراء FT-IR منفصلة لكل من NH3 (898 سم-1 - 981 سم-1)، و CO2 (2200 سم-1 - 2450 سم-1) و H2O(3793 سم-1 - 4001 سم-1) ولم يكن هناك تداخل مع مناطق من مركبات أخرى.
يوضح الجدول 2 الكميات المحسوبة تكافئيًا للغازات المنطلقة بالنسبة إلى كتلة عينة بيكربونات الأمونيوم.
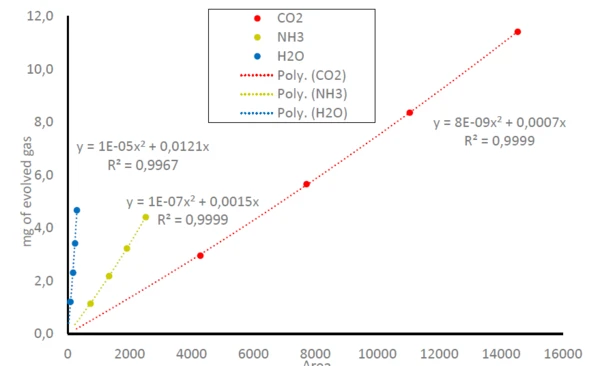
وبالتالي، يمكن ربط المساحات الموجودة أسفل آثار NH3وCO2وH2Oفي الشكل 1 بكمية الغازات المنطلقة؛ قارن المعادلة (1). ويؤدي ذلك إلى منحنيات معايرة ل NH3وCO2وH2Oحيث ترتبط المساحة المكتشفة أسفل الآثار بكمية الغازات المنطلقة؛ انظر الشكل 3. نظرًا لأن جهاز FT-IR له نطاق خطي صغير فقط، ينتج عن ذلك معادلات متعددة الحدود لجميع الجزيئات الغازية الثلاثة مع معاملات تحديد (R2) قريبة جدًا من 1. في هذه الدراسة، تم قياس كل كتلة عينة مرة واحدة فقط. قد تؤدي القياسات المتكررة أو المزيد من نقاط البيانات إلى دقة أعلى في خط الاتجاه.
الجدول 2: كتلة العينة والكميات التكافئية الناتجة من الغاز المتطور
| m (NH4HCO3) [مجم] | م (ثاني أكسيد الكربون) [مجم] | م (NH3) [مجم] [مجم] | م (H2O) [مجم] [مجم] |
| 5.31 | 2.96 | 1.14 | 1.21 |
| 10.16 | 5.66 | 2.19 | 2.31 |
| 15.01 | 8.36 | 3.23 | 3.42 |
| 20.50 | 11.42 | 4.41 | 4.67 |
كيفية اختبار دقة منحنى المعايرة
تم التحقق من دقة منحنى المعايرة بقياس آخر على NH4HCO3 بكتلة عينة محددة قدرها 15.22 مجم. تمت مقارنة الكميات النظرية لـ NH3وCO2وH2Oبالقيم المحسوبة لـ NH3وCO2وH2Oباستخدام منحنى المعايرة. وأسفر ذلك عن قيم خطأ تتراوح بين 0.8% لـ NH3 و4.9% لـ H2O؛انظر الجدول 3.
دراسة عامل النفخ - وضع النظرية موضع التطبيق العملي
في الخطوة التالية، يمكن استخدام منحنيات المعايرة التي تم الحصول عليها والتحقق منها لقياس كمية إطلاق كميات غير معروفة من الغازات المعايرة.
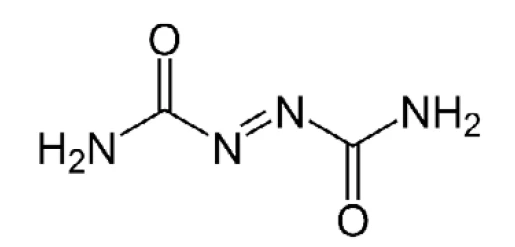
يُستخدم الأزوديكاربوناميد كعامل نفخ لإنتاج رغاوي البوليمر (للاطلاع على الهيكل، انظر الشكل 4). ويستخدم في تصنيع رغاوي PVC ورغاوي EVA-PE، حيث يشكل فقاعات عند التحلل في درجات حرارة المعالجة حيث يطلق غازات N2 وثاني أكسيد الكربون وثاني أكسيد الكربون وثاني أكسيد الكربون و NH3. يتم ضغط رغوة الفينيل بسهولة وتُظهر انتعاشًا عاليًا وسريعًا، لذلك غالبًا ما يشار إليها باسم "النابض". كما أنها تلتصق بالأسطح الملساء. ولهذا السبب، يتم استخدامه في البطانة السفلية للسجاد وحصائر الأرضيات وحصائر اليوغا.
لا يُسمح للبوليمرات التي يستخدم فيها عامل النفخ هذا بالتلامس مع الماء. قد يشكل NH3 والماء NH4OHوقد يؤدي ذلك إلى تآكل البيئة المحيطة. ولهذا السبب، فإن تحديد كمية الأمونيا من عامل النفخ هذا له أهمية كبيرة.
الجدول 3: تحديد الخطأ، مقارنة المبالغ النظرية والمحسوبة
النظري (ملغم) | المحسوبة (ملغم) | الخطأ (%) | |
| م (NH4HCO3) | 15.22 | ||
| م (NH3) | 3.28 | 3.30 | 0.801 |
| م (ثاني أكسيد الكربون) | 8.48 | 8.76 | 3.28 |
| م (H2O) | 3.47 | 3.31 | 4.86 |
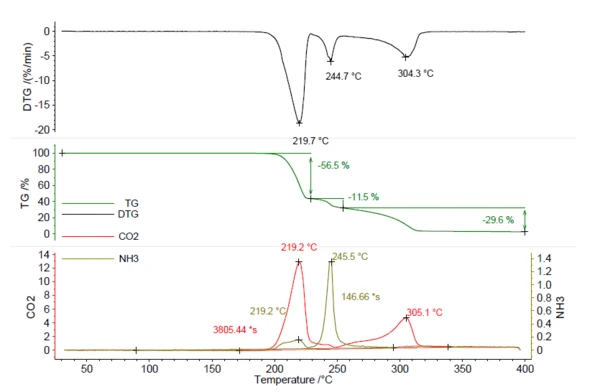
تم تسخين عينة من 5.25 مجم من أزوديكاربوناميد الأزوديكاربوناميد إلى 400 درجة مئوية عند 5 كلفن/دقيقة في جو من النيتروجين. يمكن رؤية المخطط الحراري الناتج في الشكل 5. وإجمالاً، لوحظت ثلاث خطوات فقدان للكتلة بنسبة 56.5% و11.5% و29.6% مع وجود قمم في منحنى DTG عند 219 درجة مئوية و245 درجة مئوية و304 درجة مئوية. تم إنشاء آثار ثاني أكسيد الكربون و NH3 بنفس الطريقة التي تم بها إنشاء NH4HCO3 في الشكل 1 وتم تصويرها باللون الأحمر والزيتي. وهذا يوضح أنه تم إطلاق كل من ثاني أكسيد الكربون و NH3 خلال خطوات فقدان الكتلة المختلفة ولا يمكن تحديد كميتها من خلال خطوات TGA وحدها. ولتحديد كمية هذا المركب، من الضروري الحصول على بيانات من تحليل الغاز المتطور. نتج عن حساب الأمونيا المنطلقة باستخدام منحنى المعايرة 0.22 مجم NH3 (4%). أيضًا، يمكن حساب كمية ثاني أكسيد الكربون المنطلقة بالطريقة نفسها ونتج عنها 2.78 مجم (53%). تعتبر هذه المعرفة ذات قيمة لعملية التصنيع، من أجل التأكد من إطلاق كامل كمية عامل النفخ أثناء الرغوة. إذا بقيت آثار صغيرة في المنتج، فإن درجات الحرارة التي تزيد عن 219 درجة مئوية ضرورية لبدء المزيد من الإطلاق.
الخاتمة
ويُعد الجمع بين قياس الثقل الحراري والتحليل الطيفي بالأشعة تحت الحمراء طريقة مناسبة للكشف عن إطلاق الغازات الدائمة، مثل الماء وثاني أكسيد الكربون والأمونيا. ولا يقتصر الأمر على التحديد فحسب، بل أيضًا القياس الكمي الذي يمكن أن يكون ذا أهمية هنا. وتحقيقًا لهذه الغاية، يجب إنشاء منحنى معايرة باستخدام مادة معروفة. في هذا المثال، يفي بيكربونات الأمونيوم بهذه المتطلبات تمامًا. يمكن إنشاء منحنيات معايرة في وقت واحد لـ H2O،وH2O، وCO2وH3 عن طريق تحليل ثلاثة أجزاء مختلفة من NH4HCO3. تم تحديد الانحرافات التي سيتم اختبارها من خلال قياس خامس. ومن خلال هذا الإعداد، كان من الممكن تحديد وقياس كميات غير معروفة من NH3وثاني أكسيد الكربون من عامل النفخ azodicarbonamide المستخدم في رغاوي البوليمر.