Einleitung
Während der thermischen Behandlung verschiedener Materialien kann es zur Freisetzung von Ammoniak kommen, der einen beißenden Geruch aufweist und das Bronchialsystem angreifen kann. Die Freisetzung von Ammoniak kann durch eine Vielzahl unterschiedlicher Prozesse verursacht werden. Diese reichen von der thermischen Zersetzung von Salzen über Dämpfe bei der Tabakverbrennung bis hin zur Pyrolyse von Polymeren wie Polyamid (PA) und der Herstellung von Kunststoffschäumen, die Treibmittel benötigen. Allgemein bekannte Produkte der letzteren Kategorie sind Yogamatten. Bei der Freisetzung von Ammoniak kann durch Reaktion mit Schwefelsäure und Salpetersäure unter Bildung von Salzen Feinstaub entstehen. In der Umwelt kann die Freisetzung von Ammoniak zur Versauerung des Bodens führen. Eine der Hauptquellen von Ammoniak in der Umwelt ist die Landwirtschaft und besonders beim Düngen mit dung- und stickstoffhaltigen Mineraldüngemitteln.
Deshalb ist die Quantifizierung von freigesetztem Ammoniak für viele Anwendungen wichtig. Die temperaturabhängige Freisetzung von Ammoniak lässt sich einfach mittels TG-FT-IR ermitteln. Für die Quantifizierung des Ammoniakanteils ist eine Kalibrierkurve mit bekannter Ammoniakkonzentration erforderlich. Als Verbindung eignet sich dafür Ammoniumbicarbonat, da es neben der Freisetzung von Wasser und Kohlendioxid auch Ammoniak in einem stöchiometrischen Verhältnis freisetzt, siehe Gleichung (1). Es entstehen nur gasförmige Verbindungen:
(1) NH4HCO3-> NH3 + H2O + CO2
Erstellung einer Kalibrierkurve
Für diese Studie wurde eine NETZSCH PERSEUS® TG 209 F1 Libra® verwendet. Die Aufheizung von Ammoniumbicarbonat (auf Basis der Messbedingungen in Tabelle 1) führte zur vollständigen Zersetzung bis 200°C mit einem Peak in der Massenverlustrate bei 127 °C.
Tabelle 1: Messbedingungen zur Erstellung einer Kalibrierkurve
| Parameter | NH4HCO3 | |||
| Temperaturprogramm | RT - 200 °C, 5 K/min | |||
| Durchflussrate | 40 ml/min | |||
| Probenhalter | Standard-Probenträger | |||
| Gasatmosphäre | Stickstoff | |||
| Tiegel | Al2O3 (85 μl) offen | |||
| Probeneinwaage | 5,31 mg | 10,16 mg | 15,01 mg | 20,50 mg |
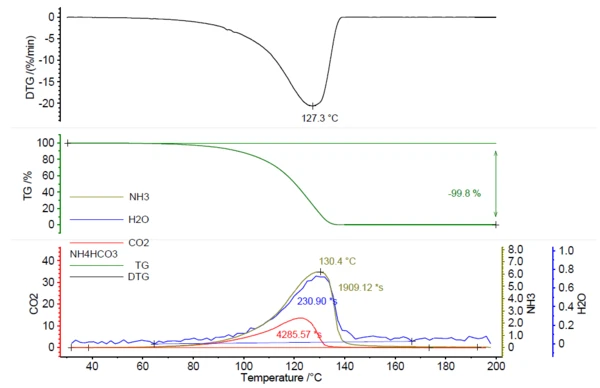
In Korrelation zum Massenverlust wurde die Freisetzung IR-aktiver Gase detektiert, siehe Abbildung 1.
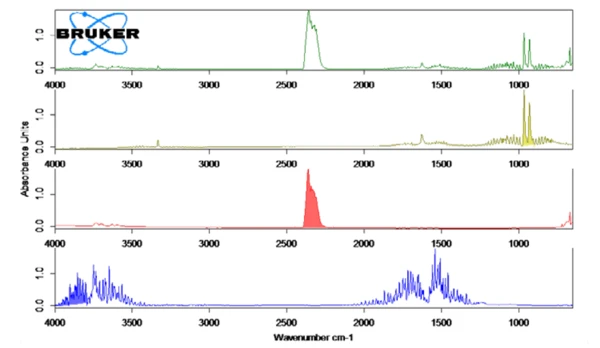
In Abbildung 2 ist das gemessene FT-IR-Spektrum bei 130 °C (grün) in Zusammenhang mit den Bibliotheksspektren von Ammoniak (olive), Wasser (blau) und Kohlendioxid (rot) dargestellt. Die temperaturabhängige Freisetzung dieser Verbindungen wurde in Abbildung 1 als Spuren aufgetragen, die durch Integration der farbigen Bereiche der FT-IR-Spektren (siehe Abbildung 2) für jede Verbindung über den gesamten Temperaturbereich erzeugt wurden. Diese Bereiche der FT-IR-Spektren waren getrennt für NH3 (898 cm-1 - 981 cm-1), CO2 (2200 cm-1 - 2450 cm-1) und H2O (3793 cm-1 - 4001 cm-1) und es gab keine Überlappung mit Bereichen von anderen Verbindungen. Die Messungen wurden mit unterschiedlichen Probeneinwaagen wiederholt.
In Tabelle 2 sind die stöchiometrisch berechneten Mengen der freigesetzten Gase im Verhältnis zur Probenmasse von Ammoniumbicarbnat aufgeführt.
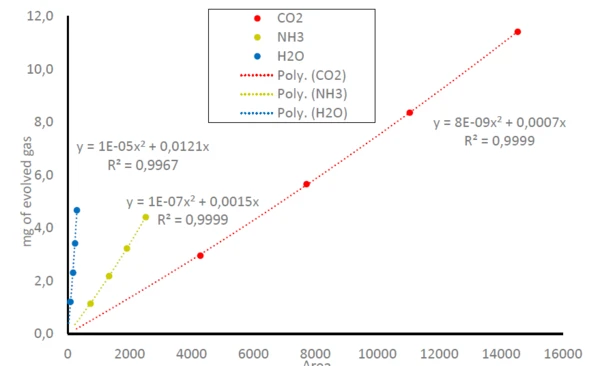
Folglich können die Flächen unterhalb der Spuren von NH3, CO2 und H2O in Abbildung 1 auf die Menge der freigesetzten Gase bezogen werden, vergleiche Gleichung (1). Dies resultiert in Kalibrierkurven für NH3, CO2 und H2O, bei denen die detektierte Fläche unterhalb der Spuren mit der Menge des freigesetzten Gases in Beziehung gesetzt werden kann, siehe Abbildung 3. Da das FT-IR nur über einen kleinen linearen Bereich verfügt, führt dies zu polynomischen Gleichungen für alle drei gasförmigen Moleküle mit Bestimmungskoeffizienten (R2) sehr nahe an 1. In dieser Studie wurde jede Probenmasse nur einmal gemessen. Wiederholungsmessungen oder mehr Datenpunkte würden zu einer noch höheren Genauigkeit der Trendlinie führen.
Tabelle 2: Probeneinwaagen und resultierende stöchiometrische Mengen des freigesetzten Gases
| m (NH4HCO3) [mg] | m (CO2) [mg] | m (NH3) [mg] | m (H2O) [mg] |
| 5,31 | 2,96 | 1,14 | 1,21 |
| 10,16 | 5,66 | 2,19 | 2,31 |
| 15,01 | 8,36 | 3,23 | 3,42 |
| 20,50 | 11,42 | 4,41 | 4,67 |
Überprüfung der Genauigkeit einer Kalibrierkurve
Die Genauigkeit der Kalibrierkurve wurde mit einer weiteren Messung an NH4HCO3 mit einer definierten Probenmasse von 15,22 mg überprüft. Die theoretischen Mengen an NH3, CO2 und H2O wurden anhand der Kalibrierkurve mit den berechneten Werten von NH3, CO2 und H2O verglichen. Dabei ergaben sich Fehlerwerte zwischen 0,8 % für NH3 und 4,9 % für H2O (siehe Tabelle 3).
Untersuchung eines Treibmittels – Umsetzung der Theorie in die Praxis
Im nächsten Schritt könnten die erhaltenen und überprüften Kalibrierkurven zur Quantifizierung der Freisetzung unbekannter Mengen der kalibrierten Gase herangezogen werden. Azodicarbonamid wird als Treibmittel zur Herstellung von Polymerschäumen (siehe Strukturformel Abbildung 4) eingesetzt. Es findet Einsatz bei der Herstellung von PVC- und EVA-PE-Schäumen, wo es während der Zersetzung aufgrund der Freisetzung von N2, CO, CO2 und NH3 bei Verarbeitungstemperatur Blasen bildet. Vinylschaum ist leicht komprimierbar und weist eine hohe Elastizität auf, um sich schnell zu erholen, was oft als „federnd“ bezeichnet wird. Desweiteren bleibt er an glatten Oberflächen kleben und wird deshalb in Teppichunterlagen, Boden- und Yogamatten eingesetzt.
Polymere, bei denen dieses Treibmittel eingesetzt wurde, dürfen nicht mit Wasser in Kontakt kommen. NH3 und Wasser können NH4OH bilden und korrosiv wirken. Aus diesem Grund ist die Quantifizierung von Ammoniak aus diesem Treibmittel von großem Interesse.
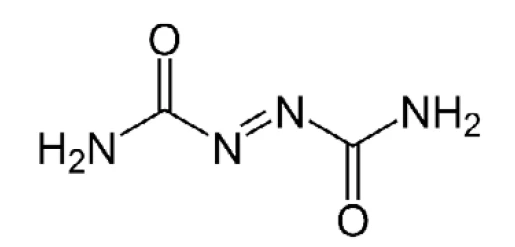
Tabelle 3: Fehlerbestimmung, Vergleich von theoretischen und berechneten Mengen
Theoretisch (mg) | Berechnet (mg) | Fehler (%) | |
| m (NH4HCO3) | 15,22 |
|
|
| m (NH3) | 3,28 | 3,30 | 0,801 |
| m (CO2) | 8,48 | 8,76 | 3,28 |
| m (H2O) | 3,47 | 3,31 | 4,86 |
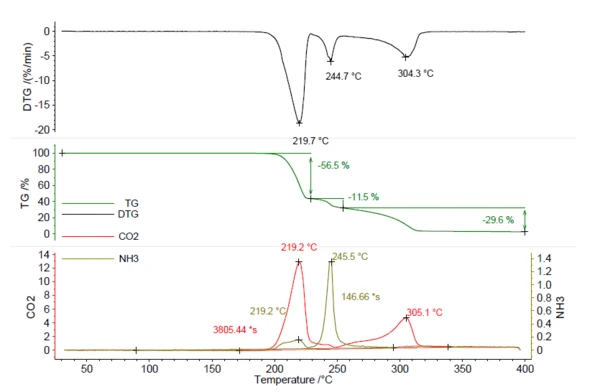
Eine Azodicarbonamid-Probe von 5,25 mg wurde mit 5 K/min bis 400 °C in Stickstoffatmosphäre aufgeheizt. Das resultierende Thermogramm ist in Abbildung 5 zu sehen. Insgesamt wurden drei Massenverluststufen von 56,5 %, 11,5 % und 29,6 % mit Peaks in der DTG-Kurve bei 219 °C, 245 °C und 304 °C beobachtet. Die Spuren von CO2 und NH3 wurden auf die gleiche Weise wie für NH4HCO3 in Abbildung 1 generiert und sind in Rot und Oliv dargestellt. Dies zeigt, dass sowohl CO2 als auch NH3 während der verschiedenen Massenverluststufen freigesetzt wurden und durch die TG-Schritte alleine nicht quantifiziert werden können. Die Quantifizierung dieser Verbindung erfordert Daten, die mittels Emissionsgasanalyse erhalten werden. Die Berechnung des freigesetzten Ammoniaks anhand der Kalibrierkurve ergab 0,22 mg NH3 (4 %). Auch die Menge des freigesetzten CO2 kann auf die gleiche Weise berechnet werden und ergab 2,78 mg (53 %). Diese Kenntnis liefert wertvolle Hinweise für den Herstellungsprozess, um sicherzustellen, dass sich die gesamte Menge des Treibmittels während des Aufschäumens freisetzt. Verbleiben geringe Spuren im Produkt, sind Temperaturen von mehr als 219 °C notwendig, um eine weitere Freisetzung zu initiieren.
Zusammenfassung
Die Kombination von Thermogravimetrie und Infrarotspektroskopie ist eine geeignete Methode, um die Freisetzung permanenter Gase, z.B. Wasser, Kohlendioxid und Ammoniak, nachzuweisen. Nicht nur die Identifizierung, sondern auch die Quantifizierung kann hier von Interesse sein. Deshalb ist es notwendig, eine Kalibrierkurve mit einem bekannten Material zu erstellen. In diesem Beispiel erfüllt Ammoniumbicarbonat diese Anforderungen perfekt. Kalibrierkurven können gleichzeitig für H2O, CO2 und NH3 erstellt werden, indem drei unterschiedliche Mengen an NH4HCO3 zersetzt werden. Die zu erwarteten Abweichungen wurden durch eine fünfte Messung bestimmt. Mit dieser Vorbereitung war es möglich, unbekannten Mengen an NH3 und CO2 aus dem in unbekannten Polymerschäumen verwendeten Treibmittel Azodicarbonamid zu identifizieren.