27.03.2023 by Dr. Ligia de Souza
DSC για τον προσδιορισμό της ιδανικής διαλυτότητας Πείτε μου πώς!
Η διαφορική θερμιδομετρία σάρωσης (DSC) είναι μια ευρέως χρησιμοποιούμενη αναλυτική τεχνική στη φαρμακευτική βιομηχανία για τη διερεύνηση των θερμικών ιδιοτήτων των φαρμακευτικών ουσιών. Μία από τις βασικές εφαρμογές της DSC είναι ο προσδιορισμός της ιδανικής διαλυτότητας ενός φαρμάκου, η οποία είναι ζωτικής σημασίας για την ανάπτυξη αποτελεσματικών και ασφαλών φαρμακευτικών σκευασμάτων. Σε αυτό το άρθρο, θα διερευνήσουμε πώς μπορεί να χρησιμοποιηθεί η DSC για τον προσδιορισμό της ιδανικής διαλυτότητας των φαρμάκων, καθώς και τους παράγοντες που μπορούν να επηρεάσουν τη συμπεριφορά της διαλυτότητας. Είτε είστε researcher, επιστήμονας ή διαμορφωτής στη φαρμακευτική βιομηχανία, αυτό το άρθρο θα σας δώσει πολύτιμες πληροφορίες σχετικά με τη χρήση του οργάνου DSC της NETZSCH Analyzing & Testing για τον προσδιορισμό της ιδανικής διαλυτότητας. Ας βουτήξουμε, λοιπόν, σε αυτό το θέμα!
Ταξινόμηση των φαρμάκων με βάση τη διαλυτότητα
Η υδατοδιαλυτότητα είναι απαραίτητη για να φτάσει ένα φάρμακο στο θεραπευτικό του στόχο, δεδομένου ότι ο ρυθμός διάλυσης επηρεάζει άμεσα τη βιοδιαθεσιμότητα του φαρμάκου. Η Φαρμακοποιία των Ηνωμένων Πολιτειών και η Ευρωπαϊκή Φαρμακοποιία ταξινομούν τα φάρμακα με βάση το κατά προσέγγιση εύρος διαλυτότητάς τους σε mg/ml. Για παράδειγμα, 100-1000 mg/ml είναι το εύρος διαλυτότητας για ένα μόριο που θεωρείται ελεύθερα διαλυτό και 0,1-1 mg/ml είναι το εύρος για ένα μόριο φαρμάκου που χαρακτηρίζεται από πολύ μικρή υδατοδιαλυτότητα. Επομένως, ο προσδιορισμός της υδατικής και μη υδατικής διαλυτότητας θα καθορίσει την καλύτερη δυνατή προσέγγιση διαμόρφωσης για ένα καλό υποψήφιο φάρμακο.
Η ιδανική διαλυτότητα δίνει την κορεσμένη συγκέντρωση μιας διαλυμένης ουσίας, σε μοριακό κλάσμα, όταν χρησιμοποιείται ένας ιδανικός διαλύτης, δηλαδή η θεωρητική περίπτωση που μια διαλυμένη ουσία διαλύεται σε έναν διαλύτη χωρίς καμία απώλεια ενέργειας κατά τη διάρκεια της διαδικασίας διάλυσης. Στην πράξη, αυτό δεν είναι εφικτό, διότι η αλληλεπίδραση διαλυμένης ουσίας-διαλύτη είναι συνήθως μη ιδανική και η χημική αλληλεπίδραση μεταξύ της διαλυμένης ουσίας και του διαλύτη μπορεί να παρεμποδίσει τη διαδικασία διάλυσης. Παραδείγματα αυτών των διαμοριακών αλληλεπιδράσεων είναι οι δεσμοί υδρογόνου, οι διηλεκτρικές ιδιότητες και η διπολική ροπή.
Ενώ η μέθοδος επιλογής για τον προσδιορισμό της διαλυτότητας ενός μορίου είναι η φασματοφωτομετρία υπεριώδους ακτινοβολίας, η ιδανική διαλυτότητα μπορεί να υπολογιστεί εάν είναι γνωστά το σημείο τήξης και η ενθαλπία τήξης της ουσίας.
Ωστόσο, τι σημαίνει ιδανική διαλυτότητα σε θερμοδυναμικούς όρους
Κατά τη διαδικασία διάλυσης, οι δεσμοί διαλυμένης ουσίας-διαλυμένης ουσίας πρέπει να σπάσουν. Η ενέργεια που απαιτείται για τη διάσπαση αυτών των δεσμών είναι ίση με την ενέργεια που απαιτείται για την τήξη ενός στερεού, δηλαδή την ενθαλπία τήξης(∆Hf). Από την άλλη πλευρά, οι δεσμοί διαλύτη-διαλύτη πρέπει επίσης να σπάσουν, ενώ οι δεσμοί διαλύτη-διαλύτη πρέπει να σχηματιστούν. Η ενέργεια που εισάγεται για το τελευταίο αυτό βήμα μπορεί να ονομαστεί ενθαλπία ανάμιξης(∆Hmix). Έτσι, η ενθαλπία διάλυσης είναι το άθροισμα της ενθαλπίας σύντηξης και της ενθαλπίας ανάμιξης:
∆Hsol = ∆Hf + ∆Hmix
Εάν η ενθαλπία ανάμιξης ισούται με μηδέν, τότε η ενθαλπία διάλυσης ισούται με την ενθαλπία σύντηξης:
∆Hsol = ∆Hf
Αυτές είναι οι κύριες θερμοδυναμικές παραδοχές για την ιδανική διάλυση ενός κρυσταλλικού υλικού. Η ιδανική διάλυση οδηγεί σε ιδανική διαλυτότητα.
Άλλες παραδοχές είναι ότι η ∆Hf είναι θετική (η σύντηξη είναι ένα ενδόθερμο γεγονός) και το ίδιο ισχύει και για τη ∆Hsol. Ωστόσο, για να συμβεί μια αυθόρμητη αντίδραση, η ελεύθερη ενέργεια Gibbs(∆G = ∆Hf -T∆S)πρέπει να είναι αρνητική- επομένως, η εντροπία(S) πρέπει να είναι θετική. Λαμβάνοντας υπόψη ότι η θερμοκρασία τήξης και η ενθαλπία τήξης είναι ανεξάρτητες από την πειραματική θερμοκρασία και ότι η διάλυση θα δώσει ένα κορεσμένο διάλυμα, η εξίσωση Van't Hoff μπορεί να εφαρμοστεί ως εξής:
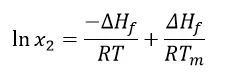
Όπου: x2 = κορεσμένη συγκέντρωση του φαρμάκου σε μονάδες μοριακού κλάσματος
∆Hf = ενθαλπία τήξης (J/mol)
r = σταθερά αερίου (J/K∙mol)
t = δεδομένη θερμοκρασία (K)
tm = θερμοκρασία τήξης (K)
Το αποτέλεσμα δίνει την κορεσμένη συγκέντρωση μιας διαλυμένης ουσίας στον ιδανικό διαλύτη, σε μοριακό κλάσμα. Με άλλα λόγια, αυτή θα είναι η μέγιστη επιτεύξιμη συγκέντρωση του φαρμάκου στον καλύτερο δυνατό διαλύτη. Στο βιβλίο Pharmaceutics του Aulton [1] αναφέρεται το παράδειγμα του ακετυλοσαλικυλικού οξέος. Η (υπολογισμένη) ιδανική διαλυτότητα του ακετυλοσαλικυλικού οξέος είναι 0,037 μοριακό κλάσμα- ο καλύτερος διαλύτης που αναφέρεται είναι το τετραϋδροφουράνιο (THF), η πειραματικά προσδιορισμένη διαλυτότητα του οποίου είναι 0,036 μοριακό κλάσμα. Το THF είναι επομένως κοντά στο να είναι ο ιδανικός διαλύτης για το ακετυλοσαλικυλικό οξύ. Ωστόσο, είναι σημαντικό να ληφθεί υπόψη ότι οι διαμοριακές αλληλεπιδράσεις μπορεί επίσης να ευνοούν τη διάλυση, παρέχοντας πειραματική διαλυτότητα υψηλότερη από εκείνη που εκτιμάται από την εξίσωση Van't Hoff.
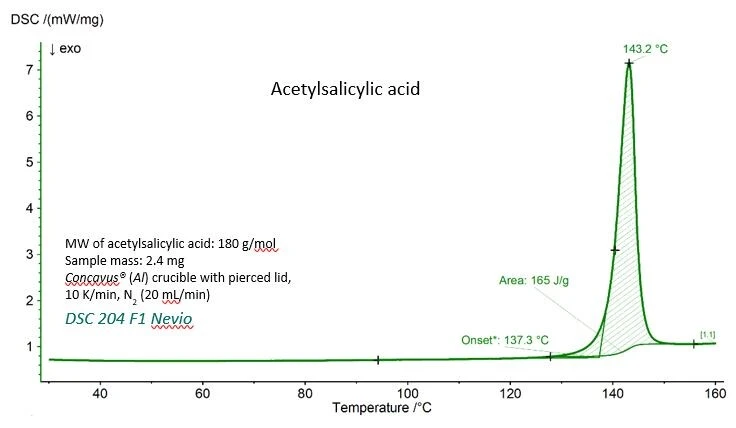
Η καμπύλη DSC για το ακετυλοσαλικυλικό οξύ με τις πειραματικές τιμές για τη θερμοκρασία τήξης (εξωστρεφής θερμοκρασία έναρξης) και την ενθαλπία τήξης (περιοχή κάτω από την κορυφή) παρουσιάζονται στο σχήμα 1. Και οι δύο τιμές συμφωνούν πολύ καλά με τις τιμές αναφοράς που δίνονται από το Εθνικό Ινστιτούτο Προτύπων και Τεχνολογίας (NIST), όπως φαίνεται στον πίνακα 1.
Πίνακας 1 - Πειραματικές τιμές και τιμές αναφοράς για τη θερμοκρασία τήξης και την ενθαλπία τήξης για το ακετυλοσαλικυλικό οξύ.
Παράμετρος | Πειραματική | Αναφορά (NIST Chemistry WebBook) |
| Θερμοκρασία τήξης (προεκτιμώμενη έναρξη) | 410.4 K (137,3 °C) | 405±10 K |
Ενθαλπία τήξης (περιοχή κάτω από την κορυφή) | 29.7 kJ/mol (165 J/g) | 29.17 - 31,01 kJ/mol |
Ασπιρίνη (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
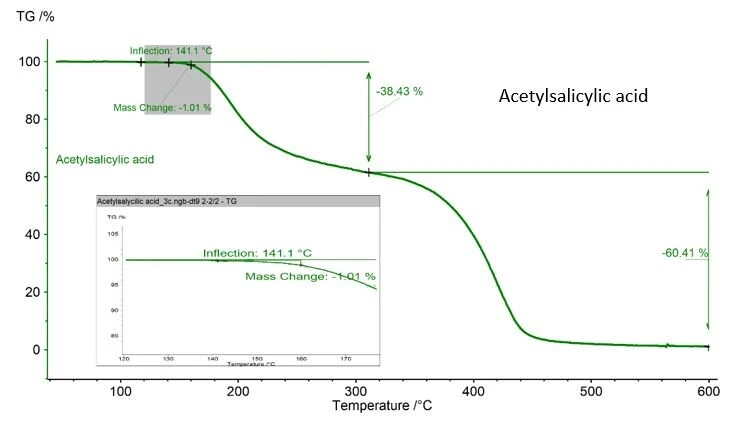
Πρέπει να δοθεί προσοχή, εάν η ουσία που αναλύεται μπορεί ενδεχομένως να υποστεί θερμική αποδόμηση κατά τη διάρκεια της μέτρησης DSC. Στην περίπτωση του παραδείγματος του ακετυλοσαλικυλικού οξέος που παρουσιάζεται εδώ, καταγράφεται απώλεια μάζας 1,01%, η οποία προσδιορίζεται με TGA NETZSCH, σχήμα 2. Η τιμή αυτή είναι αποδεκτή, καθώς το ASTM 928 ορίζει 1% ως μέγιστη μάζα στην περιοχή τήξης. Εάν δεν υπάρχει TGA, η ζύγιση του χωνευτηρίου και του δείγματος πριν και μετά τη μέτρηση είναι ο καλύτερος τρόπος για την παρακολούθηση της απώλειας μάζας.
Οι μεταπτώσεις φάσεων, η αλληλεπίδραση στερεού-στερεού, οι αλλαγές στη χημική σύνθεση και το purity determination είναι παραδείγματα εφαρμογών της DSC - μιας ευαίσθητης τεχνικής που παρέχει ακριβή και ακριβή αποτελέσματα.
Παραπομπή: Η DSC είναι μια μέθοδος που παρέχει ακριβή και ακριβή αποτελέσματα:
[1] Aulton's Pharmaceutics,6η έκδοση, ISBN: 9780702081545
Ασπιρίνη (nist.gov)https://webbook.nist.gov/cgi/cbook.cgi?ID=C50782&Units=SI&Mask=4#Thermo-Phase
Περίληψη
Συμπερασματικά, η χρήση των οργάνων της NETZSCH Analyzing & Testing μπορεί να συμβάλει σημαντικά στον προσδιορισμό της ιδανικής διαλυτότητας των φαρμάκων κατά τη διαδικασία φαρμακευτικής ανάπτυξης. Παρέχοντας πολύτιμες πληροφορίες για τις θερμικές ιδιότητες των φαρμακευτικών ουσιών, οι DSC και TGA μπορούν να βοηθήσουν τους διαμορφωτές και τους επιστήμονες να βελτιστοποιήσουν τα φαρμακευτικά σκευάσματα για βελτιωμένη βιοδιαθεσιμότητα και αποτελεσματικότητα.
Εάν ενδιαφέρεστε να μάθετε περισσότερα για το πώς η NETZSCH Analyzing & Testing μπορεί να υποστηρίξει τις ανάγκες σας για φαρμακευτική ανάπτυξη, επισκεφθείτε τον ιστότοπό μας για περισσότερες πληροφορίες. Οι ειδικοί μας είναι εδώ για να σας βοηθήσουν σε κάθε σας βήμα.
Γνωρίζετε ήδη το βιβλίο εφαρμογών μας "Θερμική ανάλυση στον φαρμακευτικό τομέα"
Αυτό το βιβλίο εφαρμογών χρησιμοποιεί μια ποικιλία συγκεκριμένων παραδειγμάτων εφαρμογών για να δείξει πώς πρέπει να διεξάγονται τα αντίστοιχα πειράματα και ποια συμπεράσματα μπορούν να εξαχθούν από τα αποτελέσματα.

Το βιβλίο περιέχει οκτώ κεφάλαια σε περισσότερες από 260 σελίδες σχετικά με:
- Μέθοδοι θερμικής ανάλυσης (DSC, TGA, STA και ανάλυση αερίων)
- Χαρακτηρισμός άμορφων και κρυσταλλικών φάσεων
- Καθαρότητα
- Θερμική σταθερότητα
- Οξειδωτική σταθερότητα
- Συνθήκες αποθήκευσης και διάρκεια ζωής
- Πολυµορφισµός και συμβατότητα