Metalli e leghe
Determinazione del punto di fusione su palladio
Il largeprimo utilizzo del palladio (Pd) è oggi quello delle marmitte catalitiche.
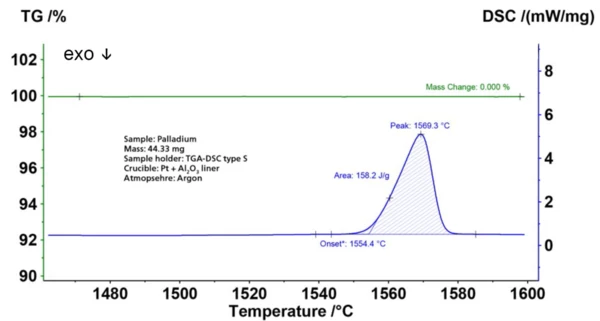
Tuttavia, viene utilizzato anche in odontoiatria, nella produzione di orologi, di strisce per il test della glicemia, di candele di accensione per aerei e nella produzione di strumenti chirurgici e contatti elettrici. Il palladio non reagisce con l'ossigeno a temperatura normale, ma se riscaldato a 800°C in aria produce uno strato di ossido di palladio(II) (PdO). Questo grafico mostra la misura STA su Pd fino a una temperatura del campione di 1600°C in atmosfera di argon. La curva DSC (blu) mostra laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione con un'entalpia di 158 J/g (curva blu, DSC) a 1554°C (temperatura di inizio). Entrambi i valori corrispondono molto bene ai dati di letteratura (< 1%) per il Pd puro. Prima e dopo laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione non si è verificata alcuna perdita di massa (curva verde); ciò conferma l'elevata purezza del metallo e la tenuta del vuoto dello STA 449 F5 Jupiter®®.