Dicas e truques
Como evitar resultados incorretos devido à preparação inadequada da amostra
Uma balança termogravimétrica mede as alterações de massa em uma amostra durante um programa de temperatura/tempo (DIN 51005). Como resultado, é possível determinar as temperaturas dos processos químicos e físicos que induzem uma mudança de massa.
Os processos incluem VaporizaçãoA vaporização de um elemento ou composto é uma transição de fase do estado líquido para o vapor. Existem dois tipos de vaporização: evaporação e ebulição.vaporização, sublimação, dessolvatação e Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição térmica e oxidativa, entre outros.
É bem sabido que a curva termogravimétrica é influenciada pelos seguintes fatores:
- Taxa de aquecimento
- Geometria da amostra
- Massa da amostra
Se, por exemplo, a taxa de aquecimento e a massa da amostra forem aumentadas, os efeitos de TGA detectados também serão deslocados para temperaturas mais altas. small No entanto, também é possível brincar com os fatores taxa de aquecimento e massa da amostra para obter o máximo de informações possível da curva de medição: melhor separação dos efeitos sobrepostos por meio da variação da taxa de aquecimento e/ou da massa da amostra, ampliação dos efeitos em escala ao aumentá-los, etc.
A preparação inadequada da amostra pode ser a causa de mais do que apenas uma mudança nas perdas de massa monitoradas pela TGA: ela pode levar a resultados significativamente diferentes. Com a termogravimetria, as amostras sólidas podem ser medidas como um pó ou um pedaço de um comprimido; os líquidos também podem ser medidos. No entanto, é preciso estar ciente de que as curvas de TGA reproduzíveis só podem ser obtidas com o uso consistente da mesma preparação de amostra (forma de amostra) e condições de medição. Em particular, a superfície da amostra influencia determinados processos, que podem ser vistos na evaporação de solventes ou na Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição oxidativa (combustão). Como consequência, esses efeitos estão associados a diferentes temperaturas, dependendo do tempo em que a amostra investigada é um pó ou composta de uma única peça. A seguir, as medições termogravimétricas são usadas para realizar a análise cinética da reação. Esse exemplo demonstra como a preparação da amostra pode ser crucial para obter as deduções corretas.
Medições de TGA-FT-IR no comprimido de ibuprofeno
As medições foram realizadas em um comprimido de ibuprofeno, Ibu 400 akut, comercializado pela 1A Pharma®. Esse comprimido contém ibuprofeno como IFA (Ingrediente Farmacêutico Ativo); esse é um dos anti-inflamatórios não esteroides (AINEs) mais usados. Além disso, também inclui excipientes que atuam como enchimentos, lubrificantes, desintegrantes, etc.
As medições foram realizadas em diferentes taxas de aquecimento entre 5 e 20 K/min com a termobalança TG 209 F1 Nevio em uma atmosfera dinâmica de nitrogênio. Foram usados cadinhos de óxido de alumínio. As massas das amostras variaram de 9,93 mg a 10,09 mg. Os gases que evoluíram durante o aquecimento foram transferidos diretamente para a célula de gás do espectrômetro FT-IR da Bruker Optics.
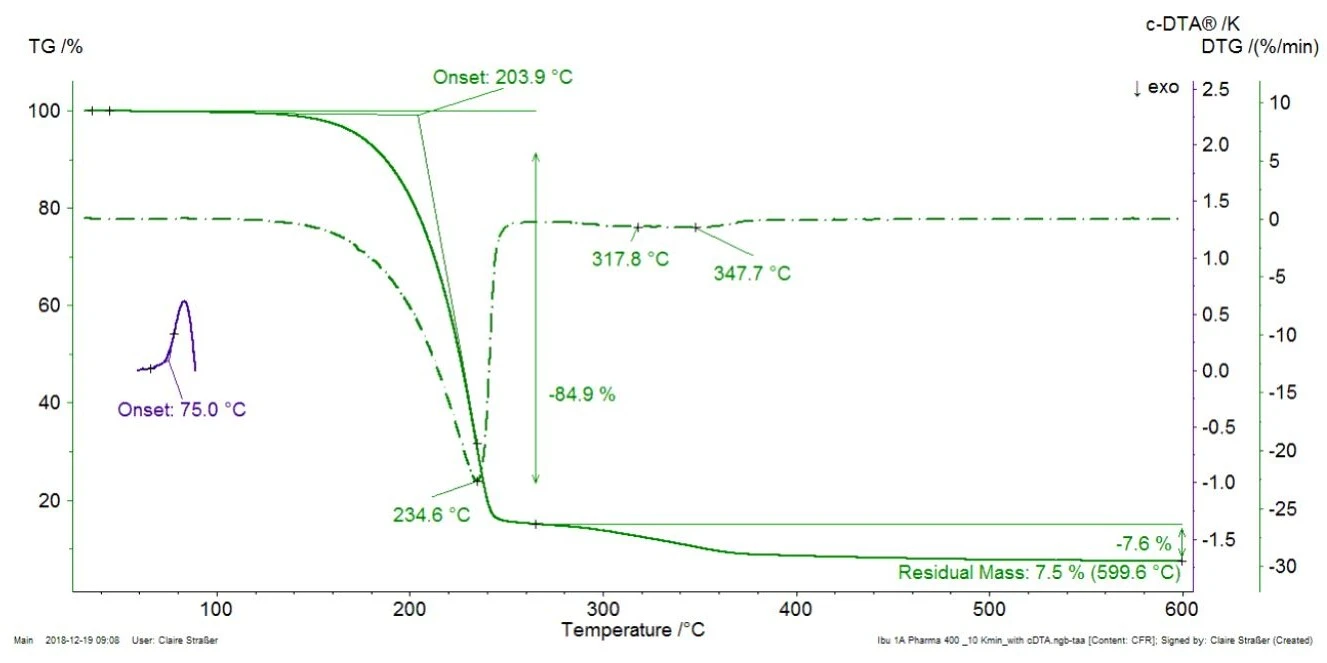
A Figura 1 exibe a medição de TGA no comprimido comercial de ibuprofeno em uma taxa de aquecimento de 10 K/min, juntamente com a curva DTG (primeira derivada da curva TGA). Além disso, o sinal DTA calculado (c-DTA®®, a diferença entre a temperatura do forno e da amostra) é exibido entre 70°C e 100°C (curva azul).
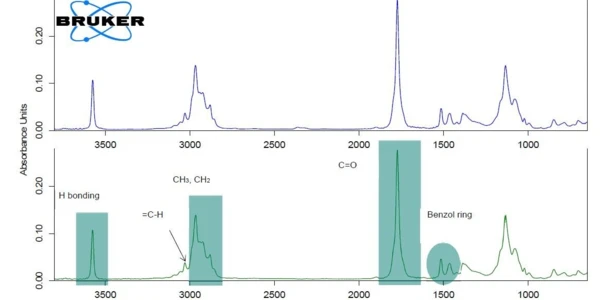
Para melhor legibilidade do gráfico, o sinal c-DTA®® foi exibido apenas na faixa deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). temperatura de fusão do ibuprofeno. O pico detectado a 75°C (temperatura de início extrapolada) não está associado a uma perda de massa; ele não resulta de Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição ou evaporação, o que induziria mudanças de massa na curva TGA, mas daTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão do ibuprofeno. A primeira perda de massa com uma temperatura de início extrapolada de 204°C chega a 85%. Isso indica a Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição ou a evaporação de um componente presente no comprimido, muito provavelmente a evaporação do ingrediente ativo, o ibuprofeno [1]. Para fins de verificação, o ibuprofeno puro também foi medido por meio de TGA-FT-IR (figura 2). Os espectros dos gases liberados a 232°C são muito semelhantes para os dois materiais.
Isso prova que a perda de massa detectada a 235°C (pico DTG, figura 1) no Ibu 400 akut resulta, na verdade, da evaporação do ingrediente ativo (ibuprofeno) e não da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição de um excipiente. Na figura 1, o Ibu 400 akut apresenta duas outras etapas de perda de massa entre 250°C e 400°C que estão parcialmente sobrepostas. Elas provavelmente se devem à decomposição térmica de excipientes presentes no comprimido, como celulose microcristalina ou estearato de magnésio [2].
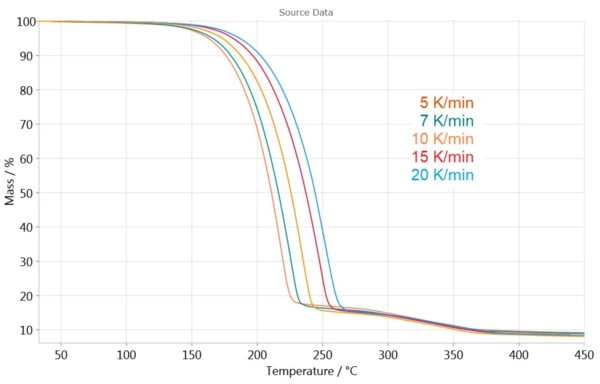
A Figura 3 mostra as medições de TGA em diferentes taxas de aquecimento. Os efeitos são deslocados para temperaturas mais altas à medida que as taxas de aquecimento aumentam. Essa dependência da curva de TGA em relação à taxa de aquecimento permite a determinação da cinética da reação.
Determinação da cinética da reação por meio do Neo Kinetics
As curvas de TGA obtidas são a base para a avaliação cinética das reações que ocorrem na faixa de temperatura medida. Para isso, foi usado o software NETZSCH Kinetics Neo. Ele permite a modelagem da cinética de reações de uma ou várias etapas.
Esse software pode atribuir cada etapa individual a diferentes tipos de reação com parâmetros cinéticos próprios, como energia de ativação, ordem de reação e fator pré-exponencial. Com base nos resultados, o Kinetics Neo é capaz de simular a(s) reação(ões) para programas de temperatura especificados pelo usuário.
Para implementar, as curvas termogravimétricas são primeiramente importadas para o software Kinetics Neo. Em seguida, um modelo de reação é selected para cada etapa (por exemplo: reação de enésima ordem). Com base no modelo de reação escolhido, o software calcula as curvas termogravimétricas. A pertinência do modelo é avaliada por meio do coeficiente de correlação entre as curvas medidas e calculadas.
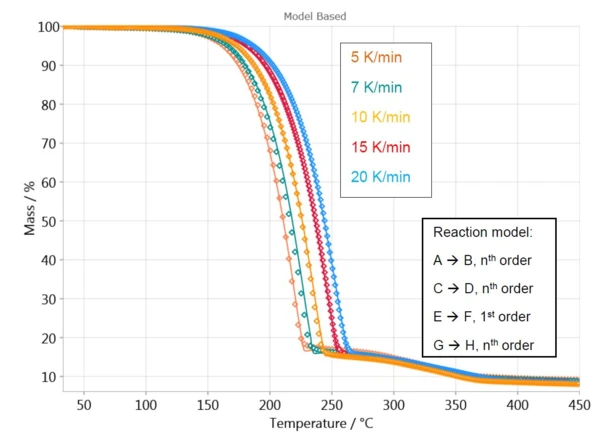
Para a primeira perda de massa, o software calcula uma curva com um modelo de reação de uma etapa, A → B. O comportamento da amostra na faixa de temperatura de 250 °C a 450 °C é descrito com três etapas independentes (C→D, E→F e G→H), porque esse é o melhor ajuste para os dados medidos nessa faixa de temperatura.
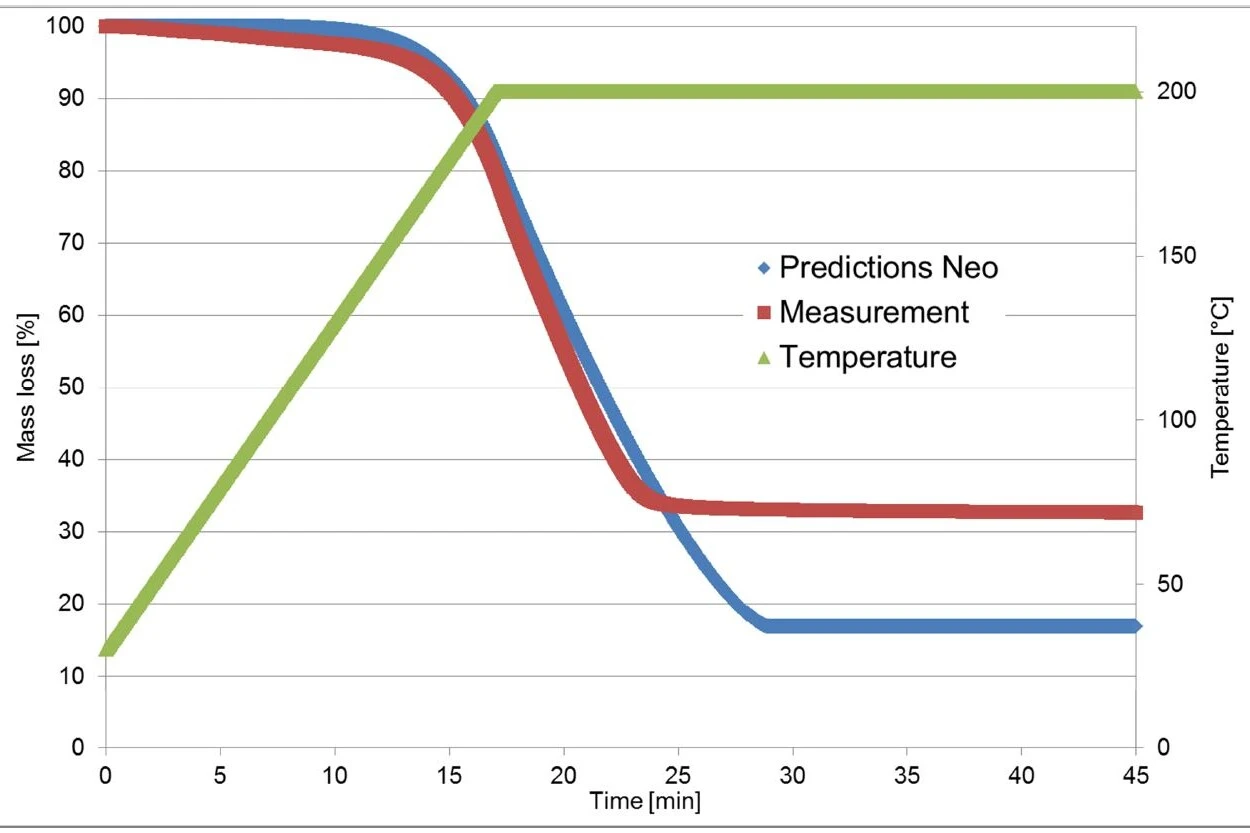
A Figura 4 exibe uma comparação das curvas medidas e calculadas para esse modelo. Com um coeficiente de correlação superior a 0,999, o modelo cinético descreve muito bem o processo de reação.
Para cada etapa da reação, o Kinetics Neo calcula os parâmetros cinéticos: energia de ativação, ordem de reação, contribuição da etapa para o processo global, etc. A Tabela 1 apresenta esses parâmetros para todas as quatro etapas.
Tab. 1. Parâmetros cinéticos para as quatro etapas
| Reação | A → B | C → D | E → F | G → H |
| Tipo de reação | enésima ordem | enésima ordem | 1ª ordem | enésima ordem |
| Energia de ativação [kJ/mol] | 77.823 | 181.866 | 148.941 | 460.643 |
| Log(PreExp) [Log(1/s)] | 6.814 | 14.911 | 10.511 | 38.543 |
| Ordem de reação | 0.286 | 1.332 | 1 | 13.410 |
| Contribuição | 0.912 | 0.022 | 0.034 | 0.033 |
Qual é o motivo da diferença observada?
As medições termogravimétricas usadas para cálculo no Kinetics Neo foram realizadas em um pedaço de um comprimido de Ibu 400 akut. Em contraste com isso, a medição de validação foi realizada em um pó produzido pela trituração do comprimido.
Conforme mencionado anteriormente, a primeira etapa de perda de massa se deve à evaporação do ibuprofeno, que depende da superfície da amostra [1]. Pode-se esperar que a superfície da amostra larger associada ao material triturado tenha uma grande influência na curva de TGA.
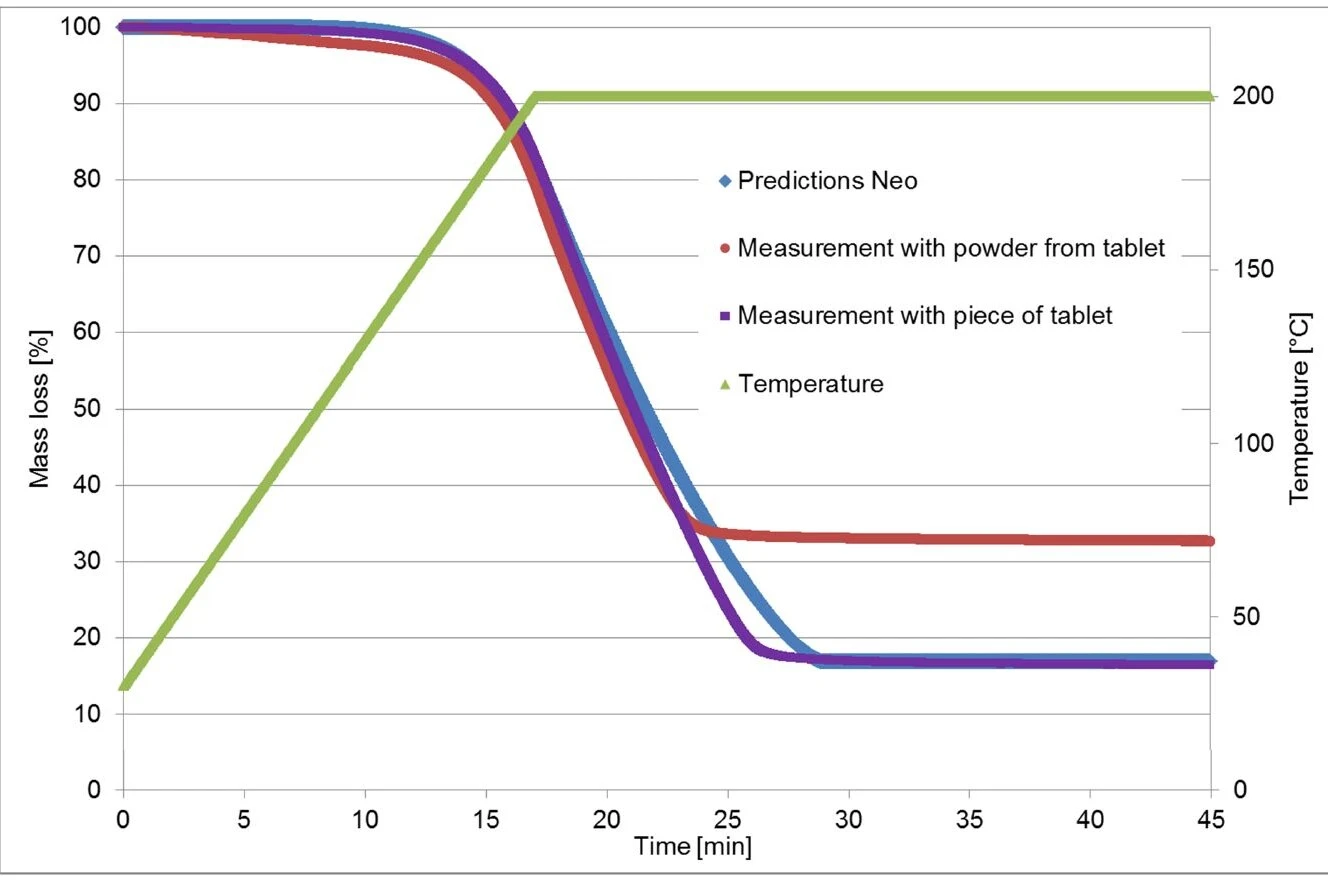
Em um segundo experimento, a medição anterior (aquecimento a 200°C e isotérmica) foi realizada novamente, mas dessa vez usando um pedaço do comprimido. A nova curva termogravimétrica agora corresponde muito bem à calculada pelo Kinetics Neo! (Veja a figura 6.)
Conclusão
Foram realizadas medições de TGA em um comprimido de ibuprofeno (nome comercial: Ibu 400): uma em uma peça sólida e outra em um pó. As medições de FT-IR foram capazes de demonstrar que a primeira etapa de perda de massa resulta da evaporação do ingrediente ativo. Além disso, esse processo é altamente dependente da superfície da amostra, de modo que os resultados das medições realizadas em um pedaço do comprimido diferem daqueles realizados no pó. Isso também tem um grande impacto sobre a análise cinética. Essa análise cinética é particularmente útil quando se investiga a Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica de um produto farmacêutico.
Referências
[1] A thermal analysis study of ibuprofen, S. Lerd-kanchanaporn and D. Dollimore, Journal of Thermal Analysis, Vol. 49 (1997), Issue 2, pp 879-886
[2] NETZSCH Nota de Aplicação 120: Estudos de compatibilidade do diclofenaco de sódio - rápido e fácil com a análise térmica; Figuras 5 e 9