Wskazówki i porady
Jak uniknąć nieprawidłowych wyników z powodu niewłaściwego przygotowania próbki
Waga termograwimetryczna mierzy zmiany masy w próbce podczas programu temperatura/czas (DIN 51005). W rezultacie możliwe jest określenie temperatury procesów chemicznych i fizycznych, które powodują zmianę masy.
Procesy te obejmują między innymi parowanie, sublimację, desolwatację orazReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład termiczny i oksydacyjny.
Powszechnie wiadomo, że na krzywą termograwimetryczną mają wpływ następujące czynniki:
- Szybkość ogrzewania
- Geometria próbki
- Masa próbki
Jeśli, na przykład, szybkość ogrzewania i masa próbki zostaną zwiększone, wykryte efekty TGA zostaną również przesunięte do wyższych temperatur. Możliwe jest jednak również wykorzystanie czynników szybkości ogrzewania i masy próbki w celu uzyskania jak największej ilości informacji z krzywej pomiarowej: lepsze oddzielenie nakładających się efektów poprzez zmianę szybkości ogrzewania i/lub masy próbki, powiększenie efektów w skali small poprzez ich zwiększenie itp.
Niewłaściwe przygotowanie próbki może być przyczyną czegoś więcej niż tylko przesunięcia strat masy monitorowanych przez TGA: może prowadzić do znacząco różnych wyników. W przypadku termograwimetrii, próbki stałe mogą być mierzone jako proszek lub kawałek tabletki; można również mierzyć ciecze. Należy jednak pamiętać, że powtarzalne krzywe TGA można uzyskać tylko poprzez konsekwentne stosowanie tego samego przygotowania próbki (forma próbki) i warunków pomiaru. W szczególności, powierzchnia próbki wpływa na niektóre procesy, co można zaobserwować w przypadku odparowywania rozpuszczalników lub rozkładu oksydacyjnego (spalania). W konsekwencji, efekty te są związane z różnymi temperaturami w zależności od tego, czy badana próbka jest proszkiem, czy składa się z pojedynczego elementu. W dalszej części pomiary termograwimetryczne są wykorzystywane do przeprowadzenia analizy kinetycznej reakcji. Przykład ten pokazuje, jak ważne może być przygotowanie próbki w celu wyciągnięcia prawidłowych wniosków.
Pomiary TGA-FT-IR tabletek ibuprofenu
Pomiary przeprowadzono na tabletce ibuprofenu, Ibu 400 akut, sprzedawanej przez 1A Pharma®. Tabletka ta zawiera ibuprofen jako API (aktywny składnik farmaceutyczny); jest to jeden z najczęściej stosowanych niesteroidowych leków przeciwzapalnych (NLPZ). Ponadto zawiera również substancje pomocnicze, które działają jako wypełniacze, lubrykanty, środki dezintegrujące itp.
Pomiary przeprowadzono przy różnych szybkościach ogrzewania w zakresie od 5 do 20 K/min za pomocą termowagi TG 209 F1 Nevio w dynamicznej atmosferze azotu. Zastosowano tygle z tlenku glinu. Masy próbek wynosiły od 9,93 mg do 10,09 mg. Gazy wydzielające się podczas ogrzewania były bezpośrednio przenoszone do celi gazowej spektrometru FT-IR firmy Bruker Optics.
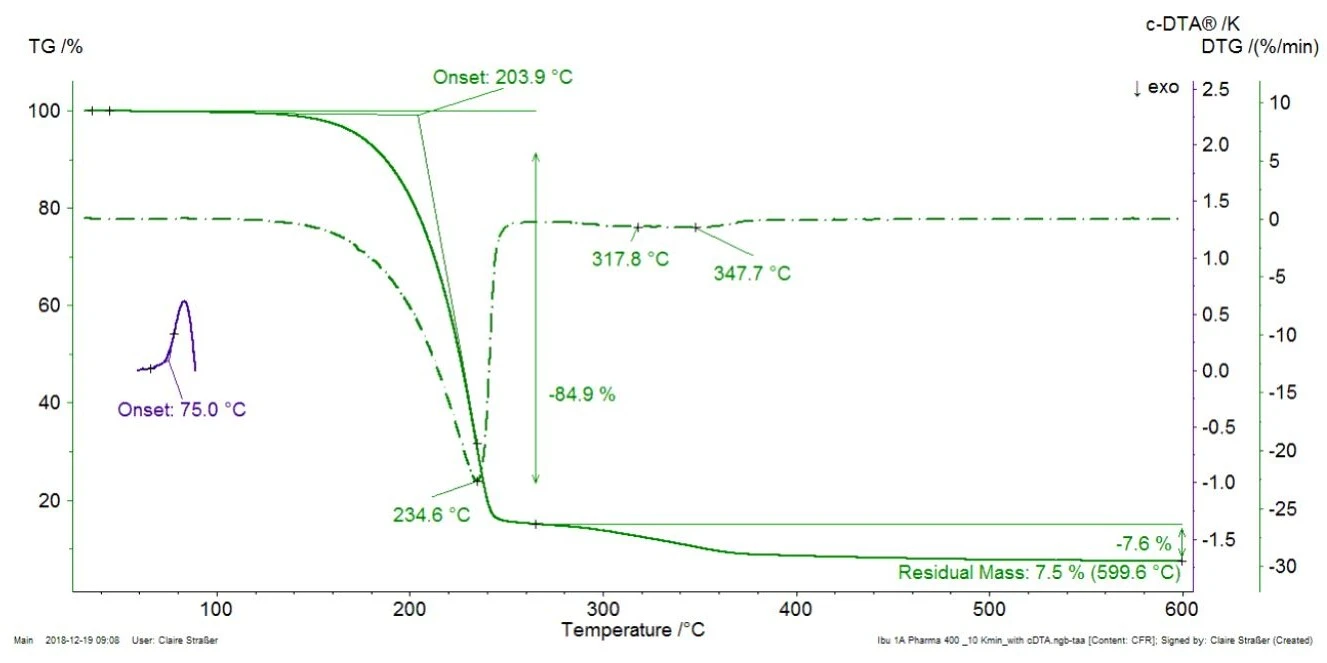
Rysunek 1 przedstawia pomiar TGA na komercyjnej tabletce ibuprofenu przy szybkości ogrzewania 10 K/min wraz z krzywą DTG (pierwsza pochodna krzywej TGA). Dodatkowo, obliczony sygnał DTA (c-DTA®®, różnica między temperaturą pieca a temperaturą próbki) jest wyświetlany w zakresie od 70°C do 100°C (niebieska krzywa).
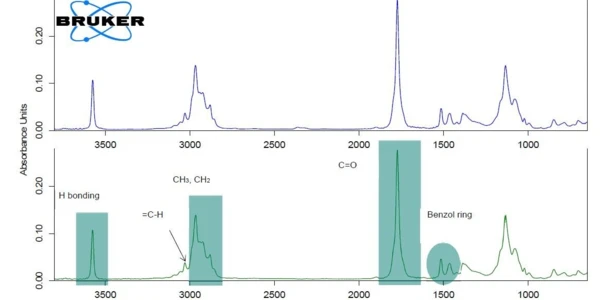
Dla lepszej czytelności wykresu, sygnał c-DTA®® został wyświetlony tylko w zakresie temperatur topnienia ibuprofenu. Pik wykryty w temperaturze 75°C (ekstrapolowana temperatura początkowa) nie jest związany z ubytkiem masy; nie wynika on z rozkładu lub parowania, które wywołałyby zmiany masy na krzywej TGA, ale z topnienia ibuprofenu. Pierwszy ubytek masy przy ekstrapolowanej temperaturze początku 204°C wynosi 85%. Wskazuje to naReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład lub OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie składnika obecnego w tabletce, najprawdopodobniej OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie składnika aktywnego, ibuprofenu [1]. W celu weryfikacji czysty ibuprofen został również zmierzony za pomocą TGA-FT-IR (rysunek 2). Widma gazów uwalnianych w temperaturze 232°C są bardzo podobne dla obu materiałów.
Dowodzi to, że ubytek masy wykryty w temperaturze 235°C (pik DTG, rysunek 1) w Ibu 400 akut faktycznie wynika z odparowania składnika aktywnego (ibuprofenu), a nie jest spowodowany rozkładem substancji pomocniczej. Na rysunku 1 Ibu 400 akut wykazuje dwa kolejne etapy utraty masy między 250°C a 400°C, które częściowo się nakładają. Są one prawdopodobnie spowodowane rozkładem termicznym substancji pomocniczych obecnych w tabletce, takich jak celuloza mikrokrystaliczna lub stearynian magnezu [2].
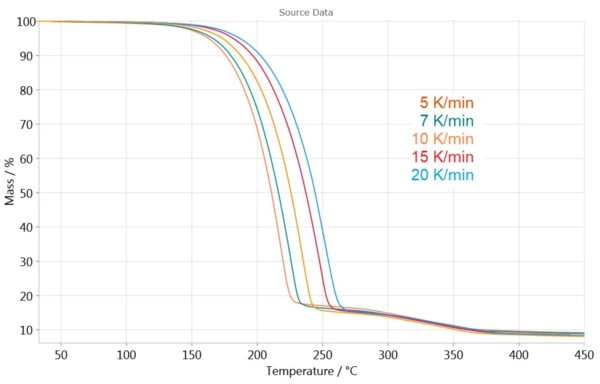
Rysunek 3 przedstawia pomiary TGA przy różnych szybkościach ogrzewania. Efekty przesuwają się w kierunku wyższych temperatur wraz ze wzrostem szybkości ogrzewania. Ta zależność krzywej TGA od szybkości ogrzewania pozwala na określenie kinetyki reakcji.
Określenie kinetyki reakcji za pomocą Kinetics Neo
Uzyskane krzywe TGA są podstawą do oceny kinetycznej reakcji zachodzących w mierzonym zakresie temperatur. W tym celu wykorzystano oprogramowanie NETZSCH Kinetics Neo. Umożliwia ono modelowanie kinetyki reakcji jedno- i wieloetapowych.
Oprogramowanie to może przypisać każdy etap do różnych typów reakcji z własnymi parametrami kinetycznymi, takimi jak energia aktywacji, kolejność reakcji i współczynnik przedwykładniczy. W oparciu o wyniki, Kinetics Neo jest w stanie symulować reakcję (reakcje) dla programów temperaturowych określonych przez użytkownika.
W celu wdrożenia, krzywe termograwimetryczne są najpierw importowane do oprogramowania Kinetics Neo. Następnie model reakcji jest selectedytowany dla każdego kroku (na przykład: reakcja n-tego rzędu). Na podstawie wybranego modelu reakcji oprogramowanie oblicza krzywe termograwimetryczne. Trafność modelu jest oceniana za pomocą współczynnika korelacji między zmierzonymi i obliczonymi krzywymi.
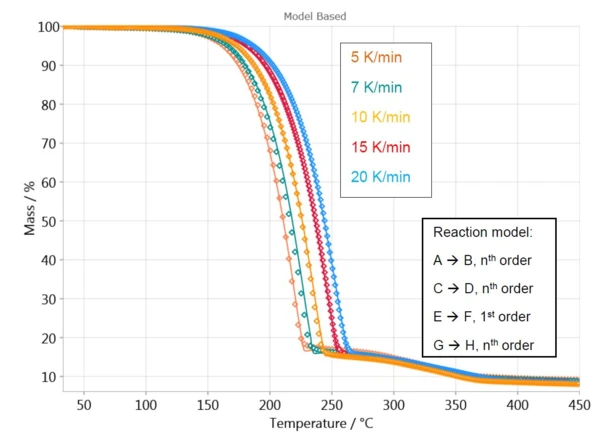
Dla pierwszej utraty masy oprogramowanie oblicza krzywą z jednoetapowym modelem reakcji, A → B. Zachowanie próbki w zakresie temperatur od 250°C do 450°C jest opisane trzema niezależnymi krokami (C→D, E→F i G→H), ponieważ jest to najlepsze dopasowanie do zmierzonych danych w tym zakresie temperatur.
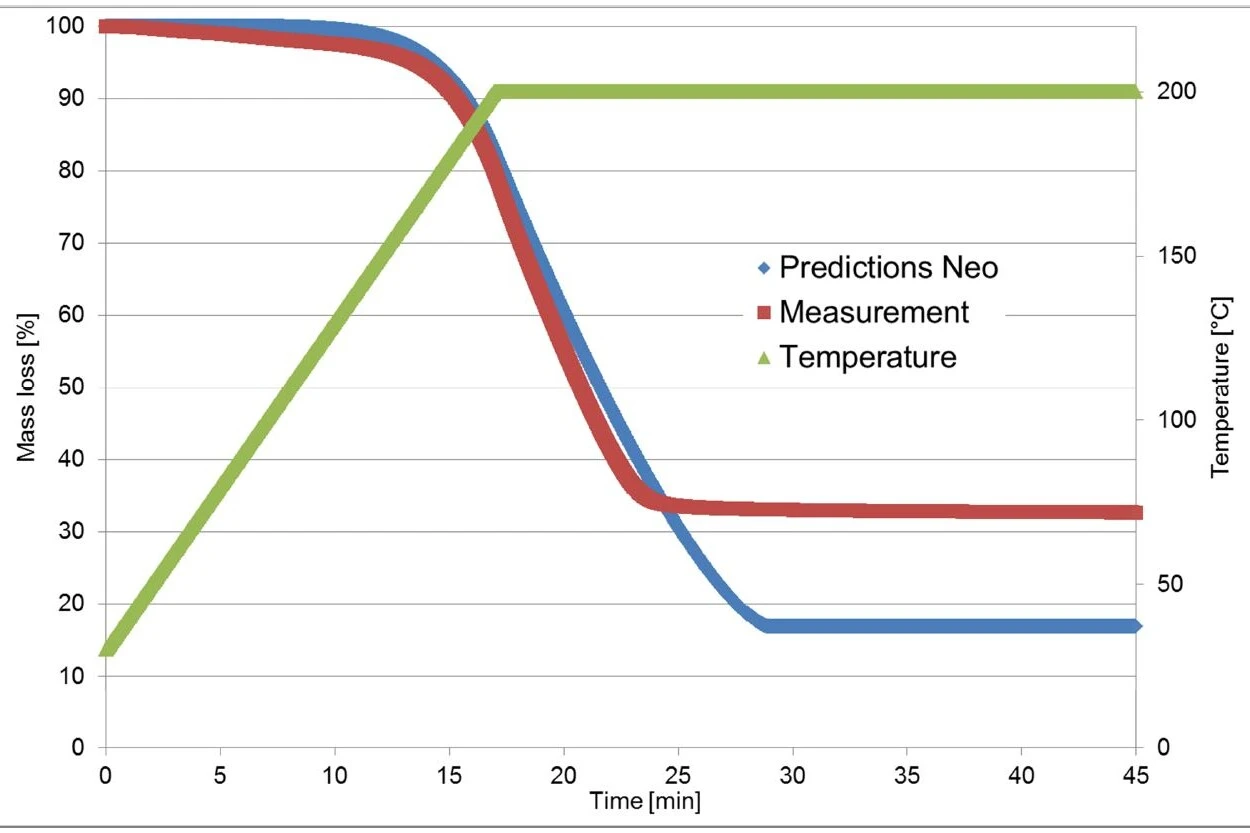
Rysunek 4 przedstawia porównanie zmierzonych i obliczonych krzywych dla takiego modelu. Przy współczynniku korelacji wyższym niż 0,999, model kinetyczny bardzo dobrze opisuje proces reakcji.
Dla każdego etapu reakcji Kinetics Neo oblicza parametry kinetyczne: energię aktywacji, kolejność reakcji, udział etapu w procesie globalnym itp. Tabela 1 przedstawia je dla wszystkich czterech etapów.
Tab. 1. Parametry kinetyczne dla czterech etapów
| Reakcja | A → B | C → D | E → F | G → H |
| Typ reakcji | n-ty rząd | n-ty rząd | 1. rząd | n-ty rząd |
| Energia aktywacji [kJ/mol] | 77.823 | 181.866 | 148.941 | 460.643 |
| Log(PreExp) [Log(1/s)] | 6.814 | 14.911 | 10.511 | 38.543 |
| Kolejność reakcji | 0.286 | 1.332 | 1 | 13.410 |
| Wkład | 0.912 | 0.022 | 0.034 | 0.033 |
Jaki jest powód zaobserwowanej różnicy?
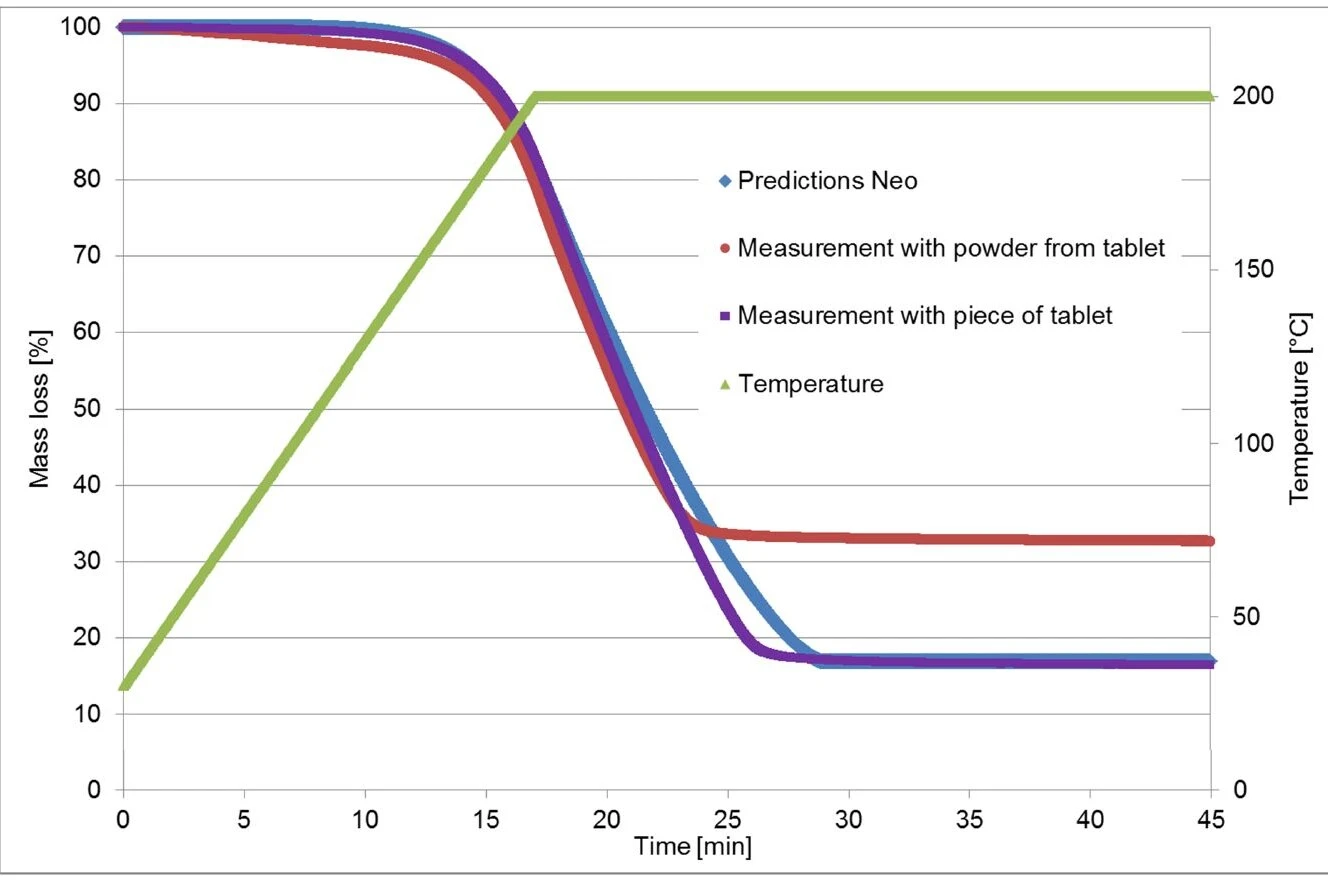
Pomiary termograwimetryczne wykorzystane do obliczeń w Kinetics Neo zostały przeprowadzone na fragmencie tabletki Ibu 400 akut. W przeciwieństwie do tego, pomiar walidacyjny został przeprowadzony na proszku wytworzonym przez zmiażdżenie tabletki.
Jak wspomniano wcześniej, pierwszy etap utraty masy jest spowodowany parowaniem ibuprofenu, które zależy od powierzchni próbki [1]. Można oczekiwać, że powierzchnia próbki larger związana z pokruszonym materiałem będzie miała duży wpływ na krzywą TGA.
W drugim eksperymencie ponownie przeprowadzono poprzedni pomiar (ogrzewanie do 200°C i izotermiczne), ale tym razem przy użyciu kawałka tabletki. Nowa krzywa termograwimetryczna teraz bardzo dobrze odpowiada tej obliczonej przez Kinetics Neo! (Patrz rysunek 6.)
Wnioski
Pomiary TGA przeprowadzono na tabletce ibuprofenu (nazwa handlowa: Ibu 400): jeden na kawałku stałym i jeden na proszku. Pomiary FT-IR wykazały, że pierwszy etap utraty masy wynika z odparowania substancji czynnej. Ponadto proces ten jest wysoce zależny od powierzchni próbki, więc wyniki pomiarów przeprowadzonych na kawałku tabletki różnią się od tych przeprowadzonych na proszku. Ma to również duży wpływ na analizę kinetyczną. Taka analiza kinetyczna jest szczególnie przydatna podczas badania stabilności termicznej farmaceutyku.
Referencje
[1] A thermal analysis study of ibuprofen, S. Lerd-kanchanaporn and D. Dollimore, Journal of Thermal Analysis, Vol. 49 (1997), Issue 2, pp 879-886
[2] NETZSCH Application Note 120: Badania kompatybilności diklofenaku sodowego - szybkie i łatwe dzięki analizie termicznej; Rysunki 5 i 9