Suggerimenti e trucchi
Come evitare risultati errati a causa di una non corretta preparazione del campione
Una bilancia termogravimetrica misura le variazioni di massa di un campione durante un programma temperatura/tempo (DIN 51005). Di conseguenza, è possibile determinare le temperature dei processi chimici e fisici che inducono una variazione di massa.
I processi comprendono, tra gli altri, la VaporizzazioneLa vaporizzazione di un elemento o di un composto è una transizione di fase dalla fase liquida al vapore. Esistono due tipi di vaporizzazione: l'evaporazione e l'ebollizione.vaporizzazione, la sublimazione, la desolvatazione e la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione termica e ossidativa.
È noto che la curva termogravimetrica è influenzata dai seguenti fattori:
- Velocità di riscaldamento
- Geometria del campione
- Massa del campione
Se, ad esempio, la velocità di riscaldamento e la massa del campione vengono aumentate, anche gli effetti TGA rilevati si spostano verso temperature più elevate. Tuttavia, è anche possibile giocare con i fattori velocità di riscaldamento e massa del campione, al fine di ottenere il maggior numero possibile di informazioni dalla curva di misura: migliore separazione degli effetti sovrapposti variando la velocità di riscaldamento e/o la massa del campione, ingrandimento degli effetti small scala aumentandoli, ecc.
Una preparazione inadeguata del campione può essere la causa di più di un semplice spostamento delle perdite di massa monitorate dalla TGA: può portare a risultati significativamente diversi. Con la termogravimetria si possono misurare campioni solidi come polvere o pezzi di compresse, ma anche liquidi. Tuttavia, si deve essere consapevoli che curve TGA riproducibili possono essere ottenute solo utilizzando costantemente la stessa preparazione del campione (forma del campione) e le stesse condizioni di misurazione. In particolare, la superficie del campione influenza alcuni processi, che possono essere osservati nell'evaporazione dei solventi o nella Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione ossidativa (combustione). Di conseguenza, questi effetti sono associati a temperature diverse a seconda che il campione analizzato sia in polvere o composto da un singolo pezzo. Di seguito, le misure termogravimetriche vengono utilizzate per effettuare l'analisi cinetica della reazione. Questo esempio dimostra quanto sia cruciale la preparazione del campione per trarre le giuste deduzioni.
Misure TGA-FT-IR sulla compressa di Ibuprofene
Le misurazioni sono state effettuate su una compressa di ibuprofene, Ibu 400 akut, commercializzata da 1A Pharma®. Questa compressa contiene ibuprofene come API (Active Pharmaceutical Ingredient); si tratta di uno dei farmaci antinfiammatori non steroidei (FANS) più utilizzati. Inoltre, comprende anche eccipienti che agiscono come riempitivi, lubrificanti, disintegranti, ecc.
Le misure sono state eseguite a diverse velocità di riscaldamento tra 5 e 20 K/min con la termobilancia TG 209 F1 Nevio in un'atmosfera dinamica di azoto. Sono stati utilizzati crogioli di ossido di alluminio. Le masse dei campioni variavano da 9,93 mg a 10,09 mg. I gas evoluti durante il riscaldamento sono stati trasferiti direttamente nella cella a gas dello spettrometro FT-IR di Bruker Optics.
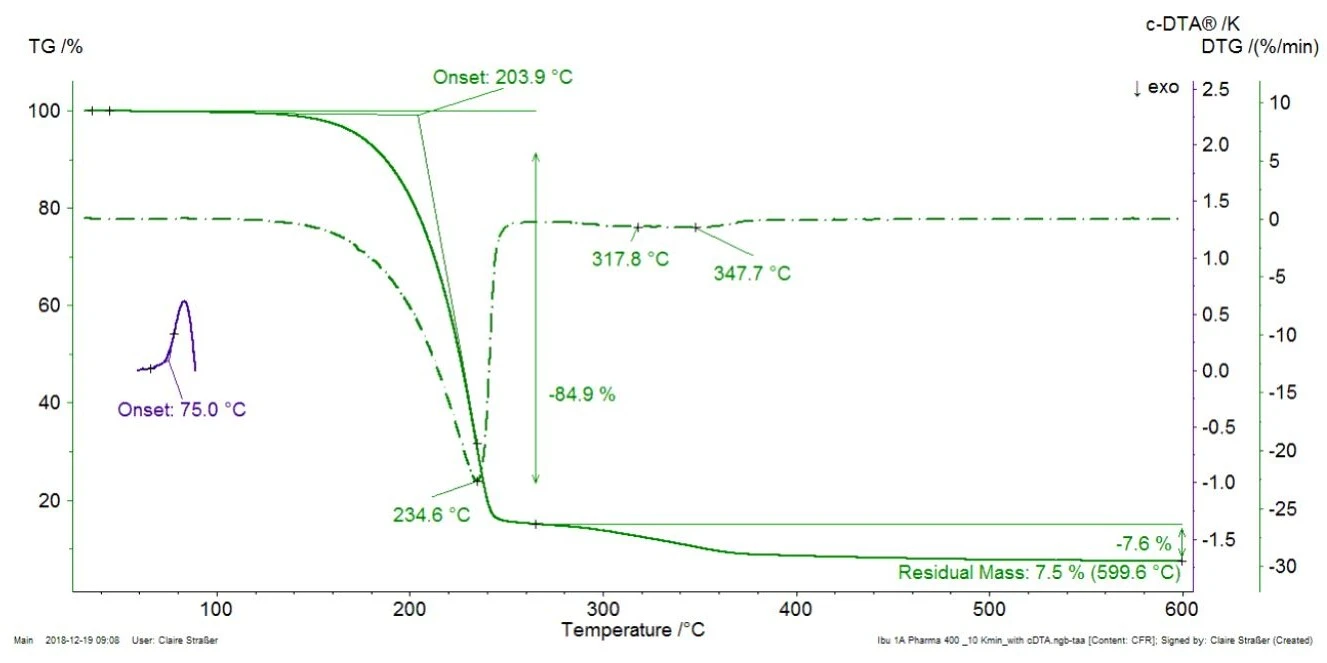
La Figura 1 mostra la misura TGA della compressa di ibuprofene commerciale a una velocità di riscaldamento di 10 K/min e la curva DTG (derivata prima della curva TGA). Inoltre, viene visualizzato il segnale DTA calcolato (c-DTA®®, la differenza tra la temperatura del forno e quella del campione) tra 70°C e 100°C (curva blu).
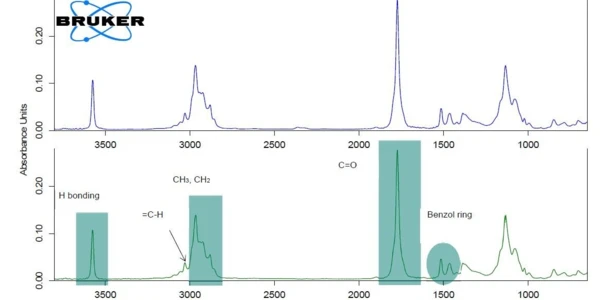
Per una migliore leggibilità del grafico, il segnale c-DTA®® è stato visualizzato solo nell'intervallo di temperatura dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'ibuprofene. Il picco rilevato a 75°C (temperatura di inizio estrapolata) non è associato a una perdita di massa; non deriva dalla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione o dall'evaporazione, che indurrebbero variazioni di massa nella curva TGA, ma dallaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'ibuprofene. La prima perdita di massa con una temperatura di insorgenza estrapolata di 204°C ammonta all'85%. Indica la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione o l'evaporazione di un componente presente nella compressa, molto probabilmente l'evaporazione del principio attivo, l'ibuprofene [1]. A scopo di verifica, l'ibuprofene puro è stato misurato anche mediante TGA-FT-IR (figura 2). Gli spettri dei gas rilasciati a 232°C sono molto simili per i due materiali.
Ciò dimostra che la perdita di massa rilevata a 235°C (picco DTG, figura 1) nell'Ibu 400 akut deriva effettivamente dall'evaporazione del principio attivo (ibuprofene) e non è dovuta alla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione di un eccipiente. Nella figura 1, l'Ibu 400 akut presenta due ulteriori fasi di perdita di massa tra 250°C e 400°C, parzialmente sovrapposte. Essi sono probabilmente dovuti alla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione termica degli eccipienti presenti nella compressa, come cellulosa microcristallina o magnesio stearato [2].
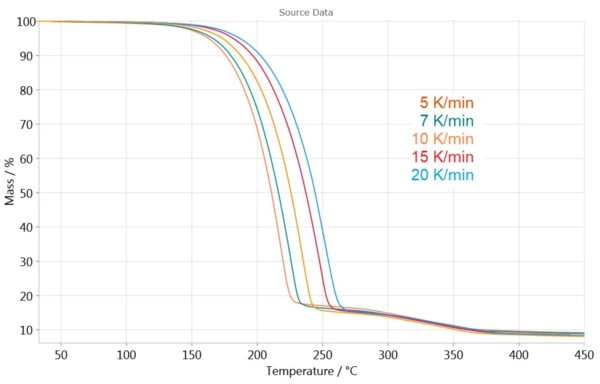
La Figura 3 mostra le misure TGA a diverse velocità di riscaldamento. Gli effetti si spostano verso temperature più elevate all'aumentare della velocità di riscaldamento. Questa dipendenza della curva TGA dalla velocità di riscaldamento consente di determinare la cinetica di reazione.
Determinazione della cinetica di reazione per mezzo della cinetica Neo
Le curve TGA ottenute sono la base per la valutazione cinetica delle reazioni che avvengono nell'intervallo di temperatura misurato. A tale scopo è stato utilizzato il software NETZSCH Kinetics Neo. Esso consente di modellare la cinetica di reazioni da uno a più stadi.
Questo software è in grado di assegnare ogni singola fase a diversi tipi di reazione con parametri cinetici propri, come l'energia di attivazione, l'ordine di reazione e il fattore pre-esponenziale. Sulla base dei risultati, Kinetics Neo è in grado di simulare le reazioni per programmi di temperatura specificati dall'utente.
Per l'implementazione, le curve termogravimetriche vengono prima importate nel software Kinetics Neo. selectQuindi, per ogni fase, viene creato un modello di reazione (ad esempio, una reazione del nono ordine). In base al modello di reazione scelto, il software calcola le curve termogravimetriche. La pertinenza del modello viene valutata attraverso il coefficiente di correlazione tra le curve misurate e quelle calcolate.
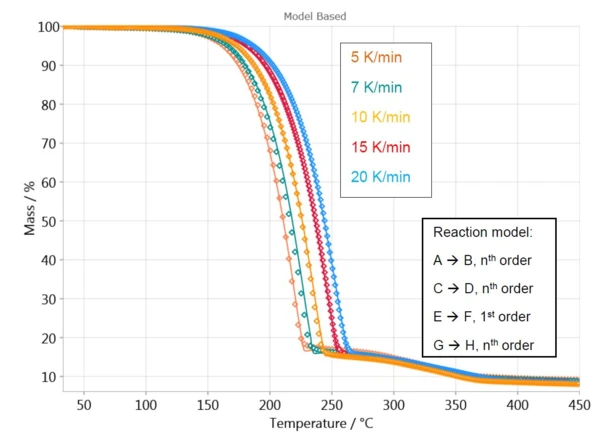
Per la prima perdita di massa, il software calcola una curva con un modello di reazione a una fase, A → B. Il comportamento del campione nell'intervallo di temperatura da 250°C a 450°C è descritto con tre fasi indipendenti (C→D, E→F e G→H) perché questo è il miglior adattamento ai dati misurati in questo intervallo di temperatura.
La Figura 4 mostra un confronto tra le curve misurate e calcolate per questo modello. Con un coefficiente di correlazione superiore a 0,999, il modello cinetico descrive molto bene il processo di reazione.
Per ogni fase di reazione, Kinetics Neo calcola i parametri cinetici: energia di attivazione, ordine di reazione, contributo della fase al processo globale, ecc. La tabella 1 li presenta per tutti e quattro i passaggi.
Scheda. 1. Parametri cinetici per le quattro fasi
| La reazione | A → B | C → D | E → F | G → H |
| Tipo di reazione | ordine n-esimo | nono ordine | 1° ordine | nono ordine |
| Energia di attivazione [kJ/mol] | 77.823 | 181.866 | 148.941 | 460.643 |
| Log(PreExp) [Log(1/s)] | 6.814 | 14.911 | 10.511 | 38.543 |
| Ordine di reazione | 0.286 | 1.332 | 1 | 13.410 |
| Contributo | 0.912 | 0.022 | 0.034 | 0.033 |
Qual è la ragione della differenza osservata?
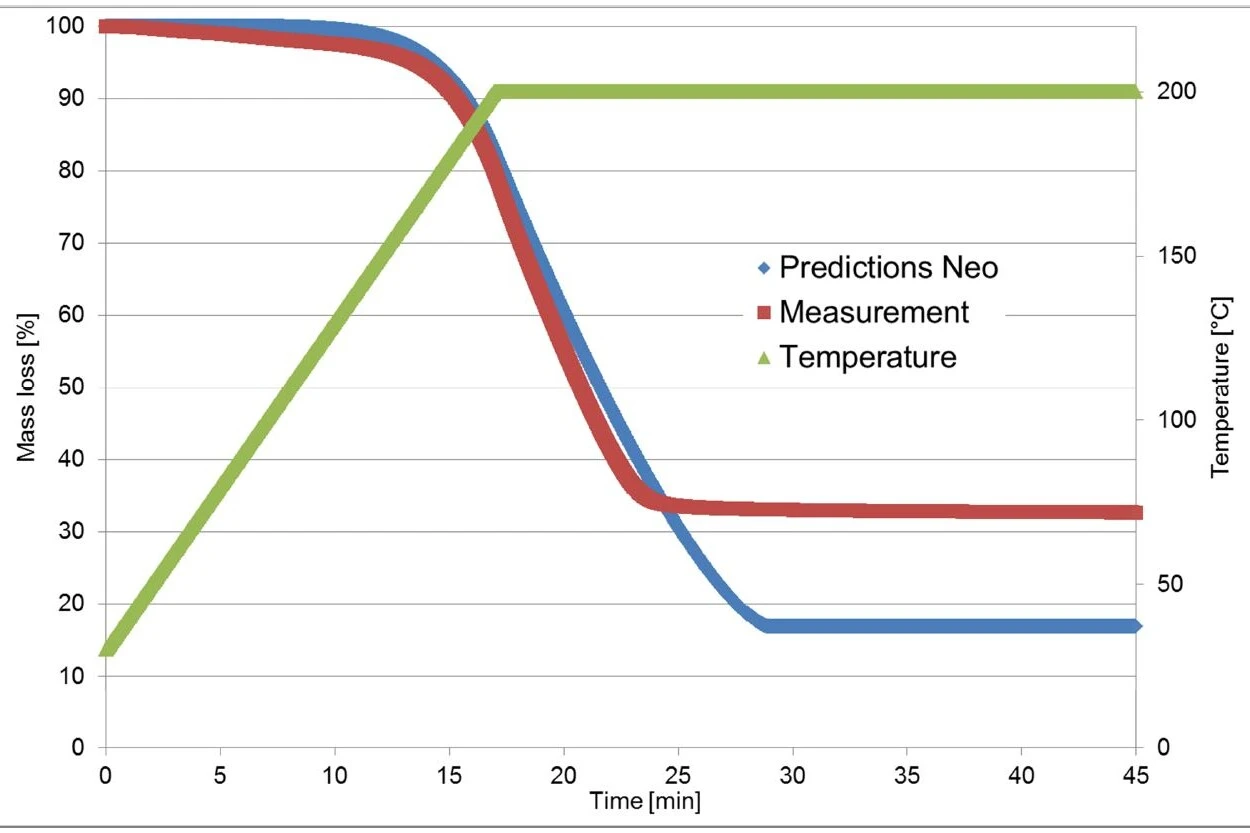
Le misure termogravimetriche utilizzate per il calcolo in Kinetics Neo sono state effettuate su un pezzo di compressa di Ibu 400 akut. Al contrario, la misura di convalida è stata effettuata su una polvere prodotta dalla frantumazione della compressa.
Come già detto, la prima fase di perdita di massa è dovuta all'evaporazione dell'ibuprofene, che dipende dalla superficie del campione [1]. Ci si può aspettare che la superficie del campione larger associata al materiale frantumato abbia una forte influenza sulla curva TGA.
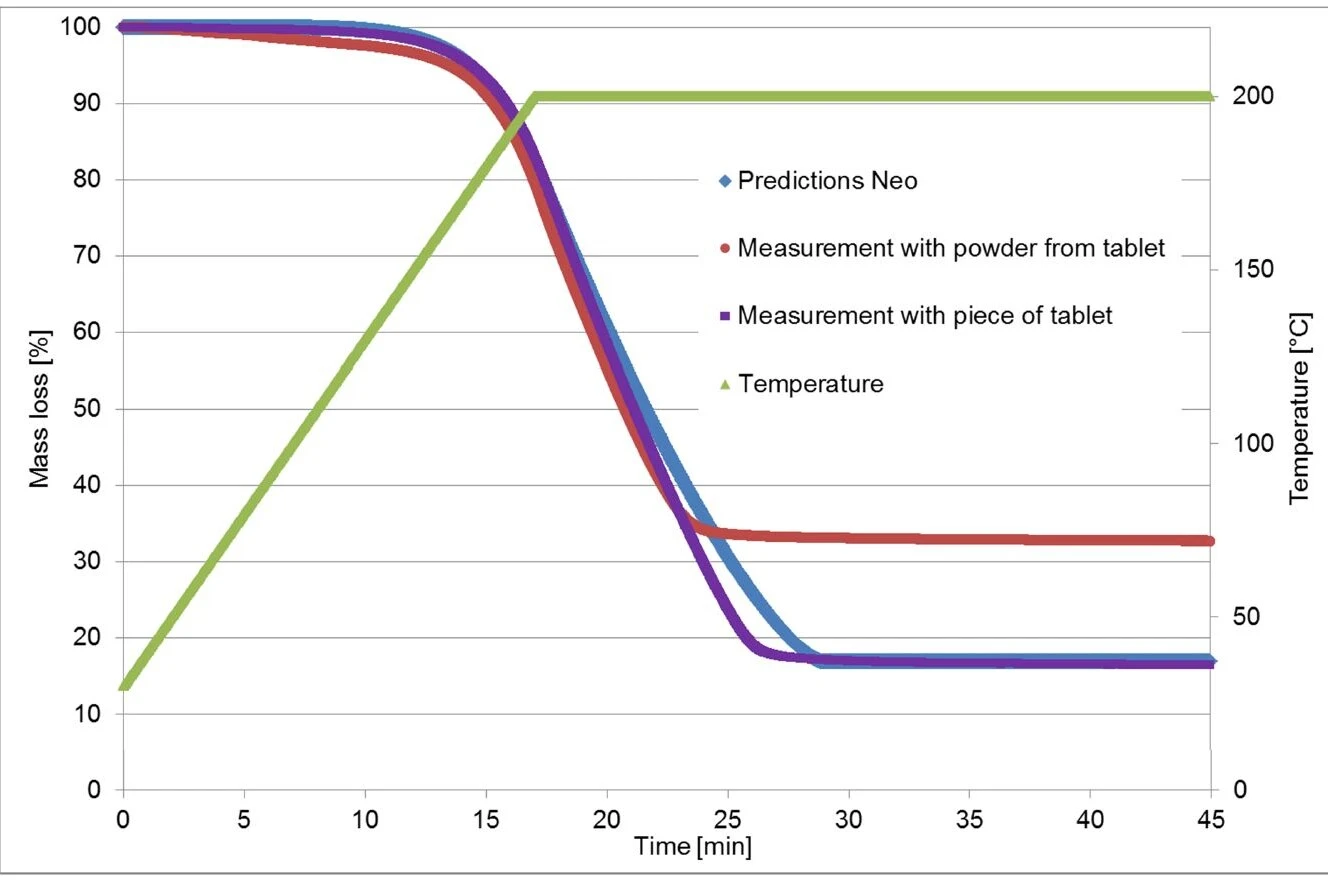
In un secondo esperimento, la misurazione precedente (riscaldamento a 200°C e isoterma) è stata eseguita nuovamente, ma questa volta utilizzando un pezzo della compressa. La nuova curva termogravimetrica corrisponde ora molto bene a quella calcolata da Kinetics Neo! (Vedi figura 6)
Conclusione
Sono state effettuate misure TGA su una compressa di ibuprofene (nome commerciale: Ibu 400): una su un pezzo solido e una su una polvere. Le misure FT-IR hanno dimostrato che la prima fase di perdita di massa è dovuta all'evaporazione del principio attivo. Inoltre, questo processo dipende fortemente dalla superficie del campione, per cui i risultati delle misurazioni effettuate su un pezzo di compressa differiscono da quelli effettuati sulla polvere. Anche questo aspetto ha un forte impatto sull'analisi cinetica. Tale analisi cinetica è particolarmente utile quando si studia la Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica di un farmaco.
Riferimenti
[1] Uno studio di analisi termica dell'ibuprofene, S. Lerd-kanchanaporn e D. Dollimore, Journal of Thermal Analysis, Vol. 49 (1997), Issue 2, pp 879-886
[2] NETZSCH Nota applicativa 120: Studi di compatibilità sul Diclofenac sodico - facili e veloci con l'analisi termica; Figure 5 e 9