
23.02.2023 by Prof. Dr. Michael Gasik (Aalto University Helsinki, Finland)
DMA о биоматериалах: Видеть невидимое!
Статья проф. Михаэля Гасика (Университет Аалто, Хельсинки, Финляндия)
В настоящее время существует множество типов биоматериалов для использования в различных имплантатах, особенно в ортопедических и стоматологических случаях. Используются металлические сплавы, керамика и композиты, как с живыми клетками, так и без них. Растет область применения различных скаффолдов, используемых в тканевой инженерии для поддержки и содействия формированию новых тканей, и многие из них изготавливаются методом 3D (био)печати. Биологическая регенерация тканей, как известно, является одной из самых сложных задач, требующих создания биоматериалов с правильными биомеханическими свойствами [1], которые имитируют поведение тканей в естественных условиях [2]. Правильно подобранные биоматериалы помогают организму восстанавливать поврежденную ткань и минимизируют связанные с этим боль и время заживления [3].
В статье профессора д-ра Михаэля Гасика (Университет Аалто, Хельсинки, Финляндия) показано новое применение метода динамико-механического анализа (ДМА) под названием BEST(Biomaterials Enhanced Simulation Testing), используемого для определения характеристик и улучшения биоматериалов и медицинских изделий; этот метод выходит за рамки известных classicи вязкоупругих анализов.

Профессор Михаэль Гасик из Университета Аалто в Финляндии (факультет химической и металлургической инженерии) начал работать в области термического анализа в 1985 году и почти столько же времени сотрудничает с NETZSCH-Gerätebau GmbH.
В центре его внимания были материалы для высокотемпературных применений и для водородных технологий. С 2000 года он активно работает с биоматериалами, медицинскими устройствами и регенеративной медициной. В 2019 году он был назначен послом Европейского ортопедического общества (European Orthopedic Research Society).
Профессор Михаэль Гасик является соучредителем компании Seqvera Ltd. и изобретателем метода BEST - Biomaterials Enhanced Simulation Testing - который впервые был реализован в оборудовании NETZSCH DMA.
arcОдним из направлений деятельности профессора Михаэля Гасика является определение механических свойств биоматериалов. В этом контексте он использует данные ДМА, полученные с помощью NETZSCH DMA 242 Artemis, в качестве основы для дальнейших расчетов для определения характеристик этих материалов. Подробнее о его подходе:
Вызовы
Уже проведены многочисленные исследования и собраны клинические данные о форме, дизайне и состоянии поверхности биоматериалов, а также о геометрии имплантатов и их соответствии качеству и расположению в различных тканях. Также сообщалось о значительных различиях между имплантируемыми материалами, которые, казалось бы, были идентичны, но происходили из разных источников [4]. Биомеханическая характеристика костных и мягких тканей является более проблематичной, чем для металлических, керамических и полимерных материалов. Опубликованные наборы данных часто не основаны на сопоставимых протоколах и условиях измерений, что приводит к отсутствию согласованности. Обобщение этих данных очень сложно или почти невозможно, когда речь идет о предоставлении простой, надежной и релевантной информации.
Для определения биомеханических характеристик обычно принимают, что материал относится к типу упругих или вязкоупругих веществ, чтобы аппроксимировать свойства в отдельные числа, обычно называемые "модулем упругости". Однако это подходит только для линейно-упругих материалов при очень small деформациях, и в руководстве NPL [5] перечислены девять методов расчета модуля упругости, которые могут приводить к различным значениям. Подавляющее большинство биоматериалов и тканей явно не являются упругими, поэтому пытаться искусственно свести данные к каким-то фиксированным числам - значительное упрощение: Например, какая польза от знания "модуля упругости слизистой", варьирующегося от 0,1 до 680 МПа по разным источникам?
К сожалению, вопросы, связанные с эффектом инерции (высокие частоты) или ограничениями инструмента (низкие частоты), не всегда достаточно документированы в опубликованных протоколах испытаний. Даже если устранить инерцию прибора, сам образец всегда будет обладать конечной инерцией, что может привести к появлению артефактов от диффузии импульса, вязкоупругих волн и вторичных потоков - все это может нарушить предположение об однородной и линейной деформации [6]. Более сложные модели имеют значительное число искусственных подгоночных параметров, и проведение таких испытаний в рамках существующих стандартов, протоколов и специальных методов испытаний сопряжено с большими экспериментальными трудностями [7].
Для таких процессов, как 3D-биопринтинг, необходимо решить ряд проблем, таких как контроль свойств биоингредиентов, управление потоком и его влиянием на жизнеспособность клеток, а также обеспечение оптимальных биофизических свойств конструкций после печати и имплантации [8]. Требуется более высокое разрешение и скорость управления 3D-микросредой, а также оптимальное сочетание механических и транспортных свойств в пространственно-временном масштабе; это необходимо, в частности, для васкуляризации с ограничением диффузии. Новые правила по медицинским изделиям (2017/745) требуют проведения надлежащей оценки механических свойств, что приводит к соблюдению правил оценки технологий здравоохранения (2021/2282).
К сожалению, множество различных методов биофизических испытаний дают довольно разные результаты, и получить реалистичные, истинные свойства нелегко. Причин различий много - неравномерный контакт, фазовое состояние, эффекты инерции и упругой нестабильности, подгонка с использованием неверных моделей, ограничение в определении деформации, отсутствие надлежащей оценки истории нагружения и т.д. Таким образом, очень важно иметь надежный подход, который может количественно оценить поведение биоматериала и его характеристики в процессе работы, а не просто получить какие-то конкретные цифры.
Концепция BEST
Для решения этих проблем мы разработали запатентованный метод BEST(Biomaterials Enhanced Simulation Testing). Он может применяться для многих твердых и мягких биоматериалов, включая гидрогели, 3D-печатные конструкции и контролируемую доставку лекарств. Решения BEST направлены на решение проблем, вызванных в первую очередь неправильным и фрагментарным тестированием, и основаны на комплексном подходе, базирующемся на фундаментальном принципе причинности: "До применения стимула образец не реагировал"
BEST проводится в контролируемых условиях с использованием необходимых когерентных стимулов в среде DMA. Он оценивает изменения свойств образца во временной, фазовой и стимульной областях [9]. В процессе постобработки BEST интегрирует данные, свертывает историю образца и извлекает неизвестные значения, не требуя от пользователя select модели материала (анализ данных по сути не требует модели). Инвариантные параметры, полученные с помощью запатентованного алгоритма квантовой регрессии, включают в себя историю образца, показывая положение и направление развития биоматериала [10].
Ключевой особенностью BEST является инвариантная обработка данных DMA, которая обычно остается неизученной для пользователя. Этот новый метод преодолевает общие ограничения линейности свойств тканей во многих моделях, а именно свойство масштабирования (однородность) и свойство суперпозиции (аддитивность), которые обычно не выполняются для преобразования Фурье, используемого в линейной вязкоупругости.
Таким образом, BEST применяет правильный протокол тестирования и использует идемпотентные методы для извлечения параметров из одного образца/теста, что приводит к получению высоких выходных данных без использования сложной математики (нет необходимости в комплексных модулях) или предположения о линейности, и способен перерабатывать также другие реологические данные таким образом, чтобы не потерять их ценность.
Пример применения DMA
В приведенном здесь примере описанный выше метод был применен на основе измерений, проведенных с помощью NETZSCH DMA 242 Artemis® для характеристики свойств акрилового гидрогеля для 3D-биопринтинга без использования предполагаемой модели. Гель помещали в 1-миллилитровый шприц с иглой 29G и устанавливали в специализированный держатель образцов DMA, который обычно используется для изгиба; гель испытывали в режиме пошаговой ползучести при 25°C.
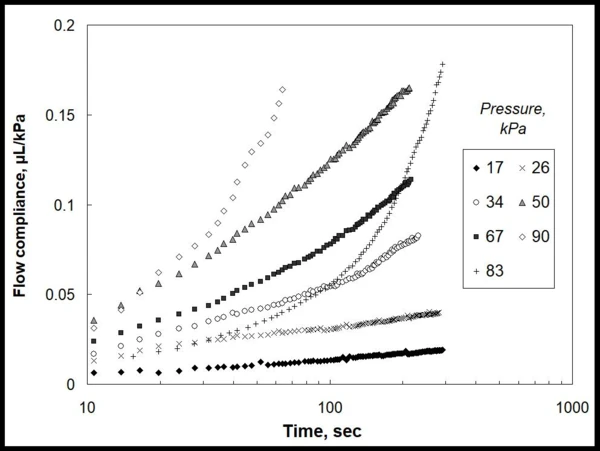
На рис. 1 представлены экспериментальные данные по количеству геля, выдавленного (мкл) через определенную насадку, нормированные на приложенное локальное давление (кПа). Эти данные ясно показывают нелинейность кинетики течения в зависимости от времени и приложенного давления, и нет прямого способа select какой-либо модели материала для описания этих зависимостей.
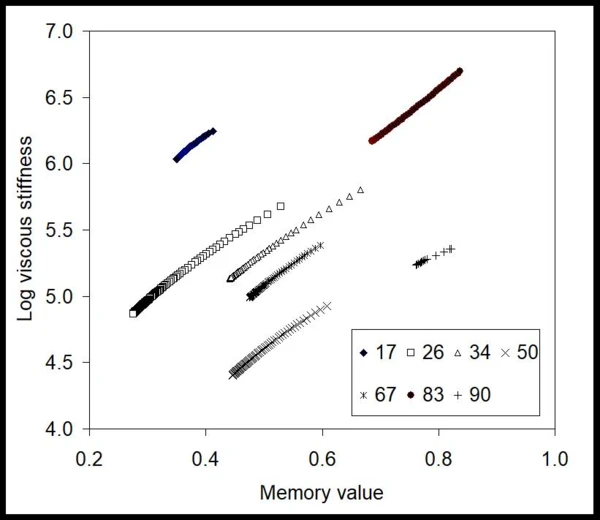
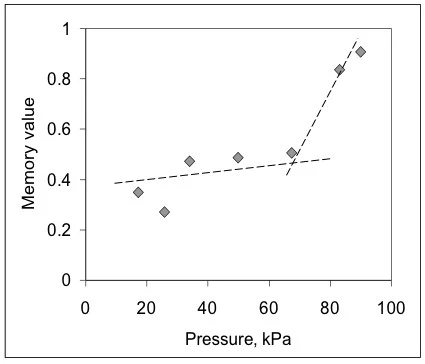
Из этих данных методом BEST были получены инвариантные по времени значения вязкой жесткости геля при данных условиях инжекции, а также величина ее памяти [9,10] (рис. 2). Здесь кривые практически линейны, а наклоны линий почти постоянны для всех приложенных давлений (числа в кПа). Это означает, что гель, несмотря на неньютоновское поведение, является линейным с точки зрения инвариантных значений без модели. Также видно, что числовые значения изменяются с изменением давления немонотонно, что говорит о наличии различных ограничивающих явлений, влияющих на течение. Для того чтобы увидеть влияние развития потока, на рис. 3 показан график зависимости значений памяти от приложенного давления. Этот график показывает, что гель в шприце сталкивается с трением, сопротивлением потоку и, возможно, эффектом отсутствия скольжения при низких давлениях, когда значения памяти намного меньше единицы. Примерно после 65 кПа - начала действия давления - эти значения резко возрастают, сигнализируя о том, что гель достигает более развитого потока.
Представленный метод позволяет определить инвариантные значения и использовать их в безмодельном прогнозировании процессов 3D-биопечати в зависимости от сопла, геометрии, давления, времени и других условий процесса, без необходимости определять реологические параметры чернил отдельно. Метод BEST генерирует данные "из первых рук" для дальнейшего прогнозного моделирования процесса 3D-печати и применяет ту же философию для определения характеристик 3D-печатных тканей и конструкций.
РЕЗЮМЕ
Разработанный подход демонстрирует возможность "видеть невидимые" особенности материалов и их взаимодействие с раздражителями и окружающей средой. Таким образом, динамико-механический анализ (ДМА ) может дать гораздо больше информации, чем модули упругости и тангенс угла потерь. Используя BEST-обработку, можно получить множество показаний для различных целей (в некоторых случаях даже от одного образца или испытания). Например, за один эксперимент можно получить модуль упругости; характерное время Дебора; ползучее соответствие; эффективную диффузию жидкости и проницаемость/проницаемость; эквивалентный размер канала для потока жидкости в динамике; величину памяти материала; давление набухания и многое другое. И это не ограничивается только биоматериалами, поскольку приложение BEST не требует моделирования и подгонки параметров; кроме того, его можно применять к уже созданным данным испытаний.
Литература:
[1] Hubbell J.A. Nature Biotechnol. 13 (1995) 565-576.
[2] Gasik M. Sci. Techn. Adv. Mater. 18 (2017) 550-562.
[3] Chung C., Burdick J.A. Adv. Drug Delivery Rev. 60 (2008) 243-262.
[4] Gasik M., Lambert F., Bacevic M, Materials 14 (2021) 2845.
[5] Lord J.D., Morrell R. Руководство по эффективной практике измерений № 98; NPL Teddington, UK (2006)
[6] Ewoldt R.H., Johnston M.T., Caretta L.M. In: Complex Fluids in Biological Systems; Springer, Germany (2015).
[7] Vrana N.E., Knopf-Marques H., Barthes J. (Eds.) Biomaterials for Organ and Tissue Regeneration; Woodhead Publ. UK (2020).
[8] Jammalamadaka U., Tappa K. J. Funct. Biomater. 9 (2018) 22
[9] Gasik M., Bilotsky Y. Patent US 10379106 B2 (2019).
[10] Gasik M.Патент США 10809171 B2 (2020).
Контактная информация:
Prof. Dr. Michael Gasik, Dr. Sci.
Terkko Health Hub, Building 14
Helsinki University Central Hospital Area
Haartmaninkatu 4, FIN-00290 Helsinki
www.seqvera.com
Большое спасибо профессору д-ру Михаэлю Гасику за эту статью и знакомство с его исследовательскойarcработой.






