
23.02.2023 by Prof. Dr. Michael Gasik (Aalto University Helsinki, Finland)
DMA o biomateriałach: Zobaczyć niewidzialne!
Artykuł autorstwa prof. dr. Michaela Gasika (Uniwersytet Aalto w Helsinkach, Finlandia)
Obecnie dostępnych jest wiele rodzajów biomateriałów do stosowania w różnych implantach, zwłaszcza w ortopedii i stomatologii. Stosowane są stopy metali, ceramika i kompozyty, zarówno z żywymi komórkami, jak i bez nich. Istnieje coraz szerszy zakres zastosowań różnych rusztowań wykorzystywanych w inżynierii tkankowej do wspierania i promowania tworzenia nowych tkanek, a wiele z nich jest wytwarzanych za pomocą (bio)druku 3D. Biologiczna regeneracja tkanek jest jednym z najbardziej wymagających wyzwań, wymagającym struktur biomateriałowych o prawidłowych właściwościach biomechanicznych [1], które naśladują zachowanie in vivo [2]. Odpowiednie biomateriały pomagają organizmowi w odbudowie uszkodzonej tkanki i minimalizują związany z tym ból i czas gojenia [3].
Niniejszy artykuł autorstwa prof. dr Michaela Gasika (Uniwersytet Aalto w Helsinkach, Finlandia) przedstawia nowe zastosowanie techniki analizy dynamiczno-mechanicznej (DMA), zwanej BEST(Biomaterials Enhanced Simulation Testing), wykorzystywanej do charakteryzowania i ulepszania biomateriałów i urządzeń medycznych; metoda ta wykracza poza znane analizy classical viscoelastic.

Prof. Michael Gasik z Uniwersytetu Aalto w Finlandii (Wydział Inżynierii Chemicznej i Metalurgicznej) rozpoczął pracę w aplikacjach analizy termicznej w 1985 roku i prawie tak długo współpracował z NETZSCH-Gerätebau GmbH.
Jego zainteresowania koncentrowały się na materiałach do zastosowań wysokotemperaturowych i technologii wodorowej. Od 2000 r. aktywnie pracuje nad biomateriałami, urządzeniami medycznymi i zastosowaniami w medycynie regeneracyjnej. W 2019 r. został mianowany ambasadorem Europejskiego Towarzystwa Badań Ortopedycznych (European Orthopedic Research Society).
Prof. Michael Gasik jest współzałożycielem Seqvera Ltd. i wynalazcą metody BEST - Biomaterials Enhanced Simulation Testing - która została po raz pierwszy wdrożona w sprzęcie NETZSCH DMA.
arcJednym z głównych obszarów działalności prof. Michaela Gasika jest określanie właściwości mechanicznych biomateriałów. W tym kontekście wykorzystuje dane DMA wygenerowane za pomocą NETZSCH DMA 242 Artemis jako podstawę do dalszych obliczeń w celu scharakteryzowania tych materiałów. Przeczytaj więcej o jego podejściu:
Wyzwania
Przeprowadzono już wiele badań i zebrano dane kliniczne dotyczące kształtu, konstrukcji i stanu powierzchni biomateriałów, a także geometrii implantów i ich przydatności do różnych jakości i lokalizacji tkanek. Znaczące różnice odnotowano również w przypadku wszczepionych materiałów, które pozornie były identyczne, ale pochodziły z różnych źródeł [4]. Biomechaniczna charakterystyka kości i tkanek miękkich jest bardziej problematyczna niż w przypadku materiałów metalowych, ceramicznych i polimerowych. Opublikowane zbiory danych często nie są oparte na porównywalnych protokołach pomiarowych i warunkach, co prowadzi do braku spójności. Uogólnienie tych danych jest bardzo trudne lub prawie niemożliwe, jeśli chodzi o dostarczenie prostych, solidnych i istotnych informacji.
W przypadku charakterystyki biomechanicznej zwykle przyjmuje się, że materiał jest rodzajem materii sprężystej lub lepkosprężystej w celu przybliżenia właściwości do poszczególnych liczb, zwykle określanych jako "Moduł sprężystościModuł zespolony (składnik sprężysty), moduł magazynowania lub G', jest "rzeczywistą" częścią ogólnego modułu zespolonego próbki. Ten składnik sprężysty wskazuje na stałą lub fazową reakcję mierzonej próbki. moduł sprężystości". To jednak pasuje tylko do materiałów liniowo sprężystych dla bardzo small odkształceń, a wytyczne NPL [5] wymieniają dziewięć metod obliczania modułu sprężystości, które mogą prowadzić do różnych wartości. Zdecydowana większość biomateriałów i tkanek wyraźnie nie jest elastyczna, więc próba sztucznego zredukowania danych do pewnych stałych liczb jest znacznym uproszczeniem: Jakie, na przykład, byłyby korzyści ze znajomości "modułu sprężystości błony śluzowej" w zakresie od 0,1 do 680 MPa z różnych źródeł?
Niestety, kwestie związane z efektami bezwładności (wysokie częstotliwości) lub limitami instrumentów (niskie częstotliwości) nie zawsze są wystarczająco udokumentowane w opublikowanych protokołach testów. Nawet jeśli bezwładność przyrządu zostanie wyeliminowana, sama próbka zawsze będzie miała skończoną bezwładność, co może powodować artefakty związane z dyfuzją pędu, falami lepkosprężystymi i przepływami wtórnymi - wszystko to może naruszać założenie jednorodnego i liniowego odkształcenia [6]. Bardziej zaawansowane modele mają znaczną liczbę sztucznych parametrów dopasowania i istnieją duże trudności eksperymentalne w przeprowadzaniu takich testów w ramach istniejących standardów, protokołów i metod testowych ad hoc [7].
W przypadku procesów takich jak biodruk 3D istnieje kilka wyzwań, którym należy sprostać, takich jak kontrolowanie właściwości biotuszów, zarządzanie przepływem i jego wpływem na żywotność komórek oraz zapewnienie optymalnych właściwości biofizycznych konstrukcji po wydrukowaniu i po implantacji [8]. Wymagana jest wyższa rozdzielczość i szybkość z kontrolą w mikrośrodowisku 3D, a optymalne połączenie właściwości mechanicznych i transportowych musi zostać osiągnięte w skali przestrzennej i czasowej; są one potrzebne w szczególności do unaczynienia ograniczonego dyfuzją. Nowe przepisy dotyczące wyrobów medycznych (2017/745) wymagają przeprowadzenia odpowiedniej oceny mechanicznej, co skutkuje przestrzeganiem przepisów dotyczących oceny technologii medycznych (2021/2282).
Niestety, wiele różnych metod testów biofizycznych daje raczej różne wyniki i nie jest łatwo uzyskać realistyczne, prawdziwe właściwości. Istnieje wiele przyczyn różnic - nierównomierny kontakt, stan fazowy, bezwładność i efekty niestabilności sprężystej, dopasowanie do niewłaściwie założonych modeli, ograniczenia w definicji odkształcenia, brak właściwej oceny historii obciążenia itp. Dlatego bardzo ważne jest, aby mieć solidne podejście, które może określić ilościowo zarówno zachowanie biomateriału, jak i jego wydajność w procesie, a nie tylko generować określone liczby.
Koncepcja BEST
Aby sprostać tym wyzwaniom, opracowaliśmy opatentowaną metodę BEST(Biomaterials Enhanced Simulation Testing). Można ją stosować do wielu twardych i miękkich biomateriałów, w tym hydrożeli, konstrukcji drukowanych w 3D i kontrolowanego dostarczania leków. Rozwiązania BEST są ukierunkowane na problemy wynikające w szczególności z niewłaściwego i fragmentarycznego testowania i opierają się na zintegrowanym podejściu opartym na podstawowej zasadzie przyczynowości: "Próbka nie zareagowała przed zastosowaniem bodźca"
BEST jest przeprowadzany w kontrolowanych warunkach z wymaganymi spójnymi bodźcami w środowisku DMA. Ocenia zmiany właściwości próbki w czasie, fazie i domenach bodźców [9]. Podczas przetwarzania końcowego BEST integruje dane, przekształca historię próbki i wyodrębnia nieznane wartości, a wszystko to bez konieczności select modelu materiału (analiza danych jest zasadniczo wolna od modelu). Niezmienne parametry uzyskane za pomocą zastrzeżonego algorytmu regresji kwantowej uwzględniają historię próbki, pokazując pozycję i kierunek rozwoju biomateriału [10].
Kluczową cechą BEST jest niezmienne przetwarzanie danych DMA, które zwykle pozostaje niezbadane przez użytkownika. Ta nowa metoda przezwycięża powszechne ograniczenia w liniowości właściwości tkanek w wielu modelach, a mianowicie właściwość skalowania (jednorodność) i właściwość superpozycji (addytywność), które nie są ogólnie utrzymywane dla transformacji Fouriera stosowanej w liniowej lepkosprężystości.
W związku z tym BEST stosuje prawidłowy protokół testowania i wykorzystuje metody idempotentne do wyodrębniania parametrów z pojedynczej próbki / testu, co skutkuje wysokimi danymi wyjściowymi bez użycia złożonej matematyki (nie ma potrzeby stosowania złożonych modułów) lub założenia liniowości i jest w stanie ponownie przetworzyć również inne dane reologiczne w taki sposób, aby nie stracić ich wartości.
Przykład zastosowania DMA
W przedstawionym przykładzie opisana powyżej metoda została wdrożona w oparciu o pomiary wykonane za pomocą NETZSCH DMA 242 Artemis® w celu scharakteryzowania właściwości hydrożelu akrylowego do biodruku 3D bez użycia założonego modelu. Żel umieszczono w strzykawce o pojemności 1 ml z igłą 29G i umieszczono w dostosowanym uchwycie próbki DMA, który jest zwykle używany do zginania; testowano go w trybie pełzania stopniowego w temperaturze 25°C.
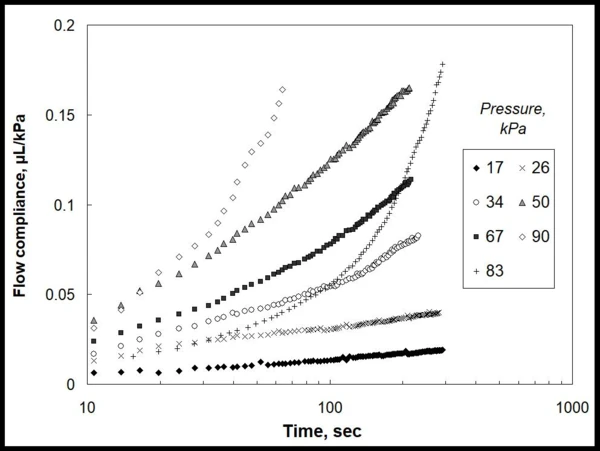
Rysunek 1 przedstawia dane eksperymentalne dla ilości żelu wytłaczanego (µL) przez określoną dyszę igłową, znormalizowaną dla zastosowanego ciśnienia lokalnego (kPa). Dane te wyraźnie ujawniają nieliniowość kinetyki przepływu z czasem i przyłożonym ciśnieniem, i nie ma prostego sposobu, aby select jakikolwiek model materiałowy opisał te zależności.
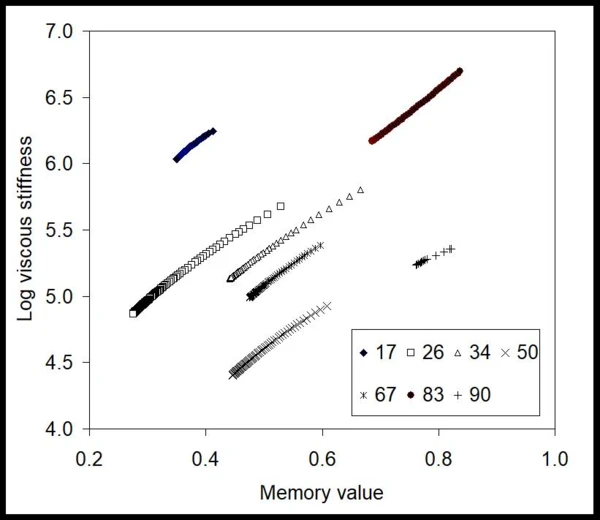
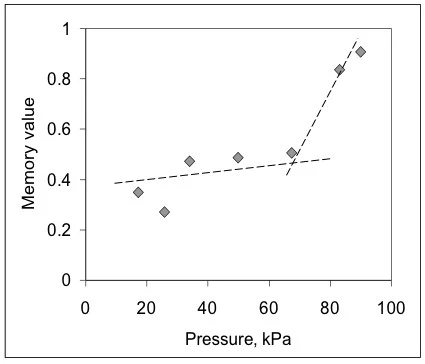
Na podstawie tych danych metoda BEST wyodrębniła niezmienne w czasie wartości sztywności lepkiej żelu w tych warunkach wtrysku, a także jego wartość pamięci [9,10] (rys. 2). W tym przypadku krzywe są prawie liniowe, a nachylenia linii są prawie stałe dla wszystkich zastosowanych ciśnień (liczby w kPa). Oznacza to, że żel, pomimo wykazywania zachowania nienewtonowskiego, jest liniowy pod względem niezmiennych wartości wolnych od modelu. Można również zauważyć, że wartości liczbowe zmieniają się wraz z przyłożonym ciśnieniem w sposób niemonotoniczny, ujawniając, że mogą istnieć różne zjawiska ograniczające wpływające na przepływ. Aby zobaczyć wpływ rozwoju przepływu, na rys. 3 przedstawiono wykres wartości pamięci w funkcji przyłożonego ciśnienia. Ta mapa pokazuje, że żel w strzykawce napotyka tarcie, opór przepływu i prawdopodobnie efekt braku poślizgu przy niskich ciśnieniach, gdy wartości pamięci są znacznie niższe niż jedność. Po około 65 kPa - początek - wartości te skaczą w górę, sygnalizując, że żel osiąga bardziej rozwinięty przepływ.
Przedstawiona metoda może określać wartości niezmienne i wykorzystywać je w bezmodelowym przewidywaniu procesów biodruku 3D, w zależności od dyszy, geometrii, ciśnienia, czasu i innych warunków procesu, bez konieczności oddzielnego określania parametrów reologicznych atramentu. Metoda BEST generuje dane "z pierwszej ręki" do dalszego modelowania predykcyjnego procesu drukowania 3D i stosuje tę samą filozofię do charakteryzowania tkanek i konstruktów drukowanych w 3D.
STRESZCZENIE
Opracowane podejście demonstruje zdolność do "widzenia niewidocznych" cech materiałów i ich interakcji z bodźcami i środowiskiem. W ten sposób analiza dynamiczno-mechaniczna (DMA) może dostarczyć znacznie więcej informacji niż moduły sprężystości i styczna stratności. Korzystając z przetwarzania BEST, można uzyskać wiele odczytów do różnych celów (w niektórych przypadkach nawet z pojedynczej próbki lub testu). Na przykład, możliwe jest uzyskanie modułu agregacji; charakterystycznego czasu Deborah; podatności na PełzaniePełzanie opisuje zależne od czasu i temperatury odkształcenie plastyczne pod wpływem stałej siły. Gdy stała siła jest przykładana do mieszanki gumowej, początkowe odkształcenie uzyskane w wyniku przyłożenia siły nie jest stałe. Odkształcenie będzie rosło wraz z upływem czasu.pełzanie; efektywnej dyfuzyjności płynu i przepuszczalności/przepuszczalności; równoważnego rozmiaru kanału dla przepływu płynu w dynamice; wartości pamięci materiału; ciśnienia pęcznienia; i więcej w ramach jednego eksperymentu. I to wykracza poza biomateriały, ponieważ aplikacja BEST jest wolna od modelu i nie wymaga żadnych parametrów dopasowania; ponadto może być również stosowana do już utworzonych danych testowych.
Literatura:
[1] Hubbell J.A. Nature Biotechnol. 13 (1995) 565-576.
[2] Gasik M. Sci. Techn. Adv. Mater. 18 (2017) 550-562.
[3] Chung C., Burdick J.A. Adv. Drug Delivery Rev. 60 (2008) 243-262.
[4] Gasik M., Lambert F., Bacevic M., Materials 14 (2021) 2845.
[5] Lord J.D., Morrell R. Przewodnik dobrych praktyk pomiarowych nr 98; NPL Teddington, UK (2006)
[6] Ewoldt R.H., Johnston M.T., Caretta L.M. In: Complex Fluids in Biological Systems; Springer, Niemcy (2015).
[7] Vrana N.E., Knopf-Marques H., Barthes J. (Eds.) Biomateriały do regeneracji narządów i tkanek; Woodhead Publ. UK (2020).
[8] Jammalamadaka U., Tappa K. J. Funct. Biomater. 9 (2018) 22
[9] Gasik M., Bilotsky Y. Patent US 10379106 B2 (2019).
[10] Gasik M.Patent US 10809171 B2 (2020).
Kontakt:
Prof. Dr. Michael Gasik, Dr. Sci.
Terkko Health Hub, Building 14
Helsinki University Central Hospital Area
Haartmaninkatu 4, FIN-00290 Helsinki
www.seqvera.com
arcSerdeczne podziękowania dla prof. dr Michaela Gasika za ten artykuł i wgląd w jego pracę badawczą.






