
23.02.2023 von Prof. Dr. Michael Gasik (Aalto University Helsinki, Finland)
DMA an Biomaterialien: Das Unsichtbare sehen!
Ein Bericht von Prof. Dr. Michael Gasik (Aalto University Helsinki, Finnland)
Gegenwärtig stehen zahlreiche Biomaterialien für die Anwendung in verschiedenen Implantaten, insbesondere in der Orthopädie und der Zahnmedizin, zur Verfügung, darunter Metalllegierungen, Keramiken und Verbundwerkstoffe, mit oder ohne lebende Zellen. Ein wachsendes Anwendungsfeld sind Gerüste, die im Tissue Engineering (Gewebekonstruktion bzw. Gewebezüchtung) dazu dienen, die Bildung neuen Gewebes zu unterstützen und zu fördern; viele davon werden durch 3D-(Bio) Druck hergestellt. Die biologische Geweberegeneration ist bekanntermaßen eine der anspruchsvollsten Herausforderungen und erfordert Biomaterialstrukturen mit maßgeschneiderten biomechanischen Eigenschaften [1], die das Verhalten im lebenden Organismus (in-vivo) simulieren [2]. Geeignete Biomaterialien unterstützen den Körper beim Wiederaufbau des geschädigten Gewebes und minimieren die damit verbunden Schmerzen sowie die Heilungszeit [3].
Dieser Beitrag von Prof. Dr. Michael Gasik (Aalto Universität Helsinki, Finnland) stellt eine neue Anwendung der dynamisch-mechanischen Analysemethode (DMA), genannt BEST (Biomaterials Enhanced Simulation Testing), zur Charakterisierung und Verbesserung von Biomaterialien und Medizinprodukten vor, die über die bekannten klassischen viskoelastischen Analysen hinausgeht.

Prof. Dr. Michael Gasik, Dr. Sci. von der Aalto Universität, Finnland (Abteilung für chemische Verfahrenstechnik und Metallurgie) arbeitet seit 1985 auf dem Gebiet der Thermischen Analyse und fast genauso lang besteht die Zusammenarbeit mit der NETZSCH-Gerätebau GmbH. Er arbeitete mit Werkstoffen für Hochtemperatur-Anwendungen für die Wasserstofftechnologie.
Seit 2000 beschäftigt er sich aktiv mit Biomaterialien, Medizinprodukten und Anwendungen der regenerativen Medizin. Im Jahr 2019 wurde er zum Botschafter der European Orthopedic Research Society ernannt. Prof. Michael Gasik ist Mitbegründer der Seqvera Ltd. und Erfinder der BEST-Methode – Biomaterials Enhanced Simulation Testing – die erstmals in DMA-Geräten von NETZSCH implementiert wurde.
Ein Schwerpunkt der Forschungsaktivitäten von Prof. Michael Gasik ist die Bestimmung der mechanischen Eigenschaften von Biomaterialien. Zur Charakterisierung dieser Materialien verwendet er die mit einer NETZSCH DMA 242 Artemis® erhaltenen Daten als Grundlage für weitere Berechnungen. Erfahren Sie im Folgenden mehr über seine Herangehensweise.
Herausforderungen
Zahlreiche Studien wurden bereits durchgeführt und klinische Daten über die Form, das Design, die Oberflächenbeschaffenheit von Biomaterialien und die Geometrie von Implantaten sowie deren Eignung für verschiedene Gewebequalitäten und Orte erhoben. Auch bei scheinbar identischen, aber aus unterschiedlichen Quellen stammenden implantierten Materialien wurden dabei signifikante Unterschiede festgestellt [4]. Die biomechanische Charakterisierung von Knochen- und Weichgeweben ist problematischer als die von metallischen, keramischen und polymeren Materialien. Veröffentlichte Datensätze beruhen oft nicht auf vergleichbaren Messprotokollen und -bedingungen. Eine Verallgemeinerung dieser Daten ist daher sehr schwierig oder nahezu unmöglich, wenn es darum geht, einfache, verlässliche und relevante Informationen zu liefern.
Bei der biomechanischen Charakterisierung geht man von elastischer oder viskoelastischer Materie aus. Auf dieser Basis lassen sich die Eigenschaften in einzelnen Zahlen approximieren, die üblicherweise als „Elastizitätsmodul“ bezeichnet werden. Allerdings gilt dies nur für linear elastische Materialien für sehr kleine Verformungen. Außerdem listen die NPL-Richtlinien [5] neun Methoden zur Berechnung des Elastizitätsmoduls auf, die zu unterschiedlichen Ergebnissen führen können.
Nahezu alle Biomaterialien und Gewebe sind eindeutig nicht elastisch, so dass der Versuch, Daten künstlich auf einige feste Zahlen zu reduzieren, eine starke Vereinfachung darstellt: Welchen Vorteil hat es, den „Elastizitätsmodul der Schleimhaut“ zu kennen, der in unterschiedlichen Quellen von 0,1 bis 680 MPa reicht?
Leider sind Probleme in Zusammenhang mit Trägheitseffekten (hohe Frequenzen) oder Einschränkungen bei den Geräten (niedrige Frequenzen) in den veröffentlichten Prüfprotokollen nicht immer ausreichend dokumentiert. Selbst wenn die Trägheit eines Geräts eliminiert wird, so weist die Probe selbst doch immer eine endliche Trägheit auf, die aufgrund von Impulsdiffusion, viskoelastischen Wellen und sekundären Strömungen zu Artefakten führen kann. Dies alles kann die Annahme einer homogenen und linearen Verformung verletzen [6]. Anspruchsvollere Modelle weisen eine beträchtliche Anzahl von künstlichen Anpassungsparametern auf und es bestehen mitunter große experimentelle Schwierigkeiten, solche Tests im Rahmen bestehender Normen, Protokolle und ad hoc-Testmethoden durchzuführen [7].
Bei Verfahren wie dem 3D-Biodruck müssen mehrere Herausforderungen bewältigt werden. Dazu gehören die Kontrolle über die Eigenschaften der zum 3D-Biodruck verwendeten Biotinten, des Fließens und dessen Auswirkungen auf die Lebensfähigkeit der Zellen sowie die optimalen biophysikalischen Eigenschaften der Konstrukte nach dem Druck und nach der Implantation [8]. Höhere Auflösung und Geschwindigkeit mit Kontrolle der 3D-Mikroumgebung sind erforderlich. Daneben muss in räumlicher und zeitlicher Hinsicht eine optimale Kombination der mechanischen Eigenschaften und Transporteigenschaften erreicht werden; dies ist insbesondere notwendig für die diffusionslimitierte Vaskularisation (Gefäßversorgung). Die neue Medizinproduktverordnung (2017/745) verlangt, dass eine ordnungsgemäße mechanische Bewertung durchgeführt wird, was in einer Zulassung nach der Verordnungen zur Gesundheitstechnologiebewertung (Health Technology Assessment, HTA, 2021/2282) resultiert.
Bedauerlicherweise führen viele verschiedene Methoden der biophysikalischen Prüfung zu recht unterschiedlichen Ergebnissen, und es ist nicht einfach, realistische, echte Eigenschaften zu erhalten. Es gibt viele Gründe für diese Unterschiede ‒ ungleichmäßiger Kontakt, Phasenzustand, Trägheits- und elastische Instabilitätseffekte, Anpassung mit falsch angenommen Modellen, Beschränkungen in der Dehnungsdefinition, Fehlen einer angemessenen Bewertung der Belastungsgeschichte usw. Daher ist es wichtig, ein solides Konzept zu haben, das sowohl das Verhalten als auch die Leistungsfähigkeit von Biomaterialien im Prozess quantifizieren kann, anstatt nur einige spezifische Zahlen zu generieren.
Das BEST Konzept
Um sich diesen Herausforderungen zu stellen, wurde die patentierte BEST-Methode (Biomaterials Enhanced Simulation Testing) entwickelt [9, 10]. Sie kann für viele harte und weiche Biomaterialien eingesetzt werden, einschließlich Hydrogelen, 3D-gedruckten Konstrukten und der kontrollierten Arzneimittelabgabe. Die BEST-Methode stellt Lösungen für Probleme bereit, die vor allem durch unsachgemäße und fragmentierte Tests verursacht werden und gründet auf einem integrierten Ansatz, der auf einem grundlegenden Kausalitätsprinzip beruht: „Es gibt keine Reaktion der Probe vor der Anregung”.
BEST wird unter kontrollierten Bedingungen mit den erforderlichen kohärenten Stimuli in der DMA-Umgebung durchgeführt. Bewertet werden Änderungen der Probeneigenschaften in den Bereichen Zeit, Phase und Stimulus [9]. Bei der Nachbearbeitung integriert BEST die Daten, verknüpft diese mit der Probenvorgeschichte und extrahiert unbekannte Werte, ohne dass der Anwender ein Materialmodell auswählten muss (die Datenanalyse ist im Wesentlichen modellfrei). Die mit dem urheberrechtlich geschützten Quantenregressionsalgorithmus gewonnenen invarianten Parameter berücksichtigen die Probenhistorie, die den Stand und die Richtung der Entwicklung eines Biomaterials aufzeigt [10].
Das Schlüsselmerkmal von BEST ist die invariante Verarbeitung von DMA-Daten, die üblicherweise vom Benutzer nicht erforscht werden. Diese neue Methode überwindet die in vielen Modellen üblichen Beschränkungen für die Linearität der Gewebeeigenschaften, namentlich die Skalierungseigenschaft (Homogenität) und die Überlagerungseigenschaft (Additivität), die für die in der linearen Viskoelastizität angewandten Fourier-Transformation im Allgemeinen nicht gelten. BEST wendet vielmehr ein zutreffendes Prüfmodell an und nutzt idempotente Methoden zur Extraktion von Parametern aus einer einzigen Probe/aus einem einzigen Test, was zu qualitativ hochwertigen Daten führt, ohne dass eine komplexe Mathematik (keine Notwendigkeit für komplexe Module) oder die Annahme von Linearität erforderlich ist. Damit ist BEST in der Lage, beispielsweise auch rheologische Daten aufzubereiten.
NETZSCH DMA-Applikationsbeispiel
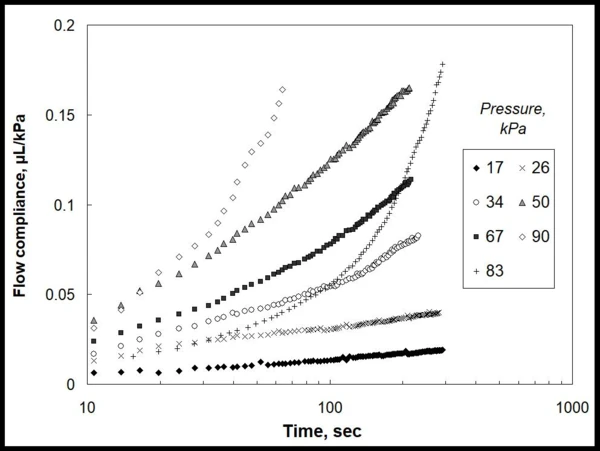
In dem hier gezeigten Beispiel (siehe auch Patent [10]) wurde die oben beschriebene Methode auf Messungen mit einer NETZSCH DMA 242 Artemis® mit dem Ziel angewandt, die Eigenschaften von Acrylhydrogel für den 3D-Biodruck ohne Annahme eines Modells zu charakterisieren. Das Gel wurde in eine 1-ml-Spritze mit einer 29G-Nadel gefüllt und in den spezifisch angepassten DMA-Probenhalter, der üblicherweise für Biegeversuche verwendet wird, eingesetzt. Die Untersuchung selbst fand im Kriechmodus mit schrittweiser Erhöhung der Kraft bei 25 °C statt. Abbildung 1 gibt die experimentellen Daten wieder. Aufgetragen ist die durch die definierte Nadeldüse gepresste Gelmenge (in µL), normiert auf den angewandten lokalen Druck (kPa), gegen die Zeit. Die Daten zeigen deutlich die Nichtlinearität der Fließeigenschaften in Abhängigkeit von der Zeit und dem ausgeübten Druck.
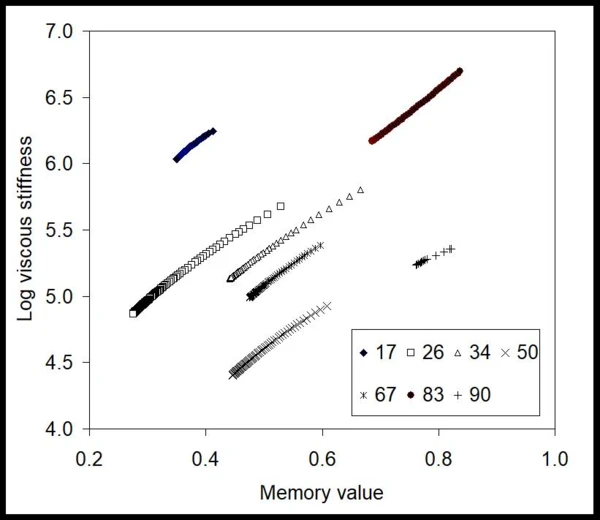
Aus diesen Daten extrahierte die BEST-Methode zeitinvariante Werte der viskosen Steifigkeit des Gels unter den Injektionsbedingungen sowie die Memory-Werte [9,10] (die die Neigung zu viskosem Verhalten beschreiben) (siehe Abb. 2). Hier ist der Verlauf der Messdaten nahezu linear, und die Steigungen der Linien für alle angewandten Drücke nahezu konstant (Einheiten der Zahlen in der Legende: kPa).
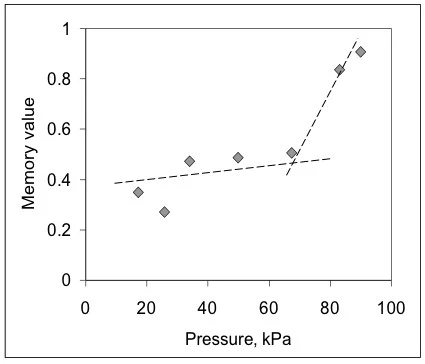
Dies bedeutet, dass das Gel, obwohl es ein nicht-Newtonsches Verhalten zeigt, sich hinsichtlich der modellfreien invarianten Werte linear verhält. Es zeigt weiterhin, dass sich die numerischen Werte nicht monoton mit dem angewandten Druck ändern; ein Anzeichen, dass es verschiedene limitierende Phänomene geben kann, die das Fließen beeinflussen. Um einen Eindruck zu gewinnen, wie sich die Fließentwicklung auswirkt, ist in Abbildung 3 der Verlauf der Memory-Werte gegen den ausgeübten Druck dargestellt. Dieses Diagramm zeigt, dass das Gel in der Spritze bei niedrigen Drücken, wenn die Memory-Werte viel niedriger als 1 sind, mit Reibung, Fließwiderstand und möglicherweise mit rutschhemmenden Effekten konfrontiert sind. Nach ca. 65 kPa – dem Onset – steigen diese Werte sprunghaft an, was darauf hindeutet, dass das Gel stärker fließfähig wird.
Mit der vorgestellten Methode können invariante Werte ermittelt und für die modellfreie Vorhersage von 3D-Biodruckprozessen in Abhängigkeit von Düse, Geometrie, Druck, Zeit und anderen Prozessbedingungen verwendet werden, ohne dass die rheologischen Parameter der Tinte separat bestimmt werden müssen. Die BEST-Methode generiert “Daten aus erster Hand” für die weitere Entwicklung von Vorhersagemodellen für den 3D-Druckprozess und wendet die gleiche Philosophie für die Charakterisierung der 3D-gedruckten Gewebe und Konstrukte an.
FAZIT
Der entwickelte Ansatz zeigt die Fähigkeit, “unsichtbare” Eigenschaften von Materialien und ihre Wechselwirkungen mit den Stimuli und der Umgebung zu erkennen. Auf diese Weise kann die dynamisch-mechanische Analyse (DMA) viel mehr Informationen liefern als nur Elastizitätsmodule und Verlustfaktoren. Je nach Verwendungszweck erhält man durch Anwendung der BEST-Methode viele unterschiedliche Daten (in einigen Fällen sogar aus einer einzigen Probe oder Prüfung). Und das nicht nur für Biomaterialien, denn die BEST-Methode ist modellfrei und erfordert keine Anpassungsparameter und kann auch auf bereits vorhandene Prüfdaten angewandt werden.
Literaturverzeichnis:
[1] Hubbell J.A. Nature Biotechnol. 13 (1995) 565–576.
[2] Gasik M. Sci. Techn. Adv. Mater. 18 (2017) 550‐562.
[3] Chung C., Burdick J.A. Adv. Drug Delivery Rev. 60 (2008) 243–262.
[4] Gasik M., Lambert F., Bacevic M., Materials 14 (2021) 2845.
[5] Lord J.D., Morrell R. Measurement Good Practice Guide No. 98; NPL Teddington, UK (2006)
[6] Ewoldt R.H., Johnston M.T., Caretta L.M. In: Complex Fluids in Biological Systems; Springer, Germany (2015).
[7] Vrana N.E., Knopf-Marques H., Barthes J. (Eds.) Biomaterials for Organ and Tissue Regeneration; Woodhead Publ. UK (2020).
[8] Jammalamadaka U., Tappa K. J. Funct. Biomater. 9 (2018) 22
[9] Gasik M., Bilotsky Y. Patent US 10379106 B2 (2019).
[10] Gasik M.Patent US 10809171 B2 (2020).
Kontakt:
Prof. Dr. Michael Gasik, Dr. Sci.
Terkko Health Hub, Building 14
Helsinki University Central Hospital Area
Haartmaninkatu 4, FIN-00290 Helsinki
www.seqvera.com
Vielen Dank an Herrn Prof. Dr. Michael Gasik für diesen Artikel und den Einblick in seine Forschungsarbeit.







