مقدمة
يرتبط استقرار مكونات API (المكونات الصيدلانية النشطة) والسواغات ارتباطًا مباشرًا بظروف تخزينها: قد يؤثر تخزينها في درجة حرارة غير مناسبة (دافئة جدًا أو باردة جدًا) على فعاليتها وسلامتها ومدة صلاحيتها. تتطلب اختبارات ثبات تخزين المستحضرات الصيدلانية الموصوفة في المبادئ التوجيهية لمنظمة الصحة العالمية (منظمة الصحة العالمية) والمجلس الدولي لتنسيق المتطلبات الفنية للاستخدام البشري (ICH) مدة لا تقل عن 6 أشهر لإكمالها. [1, 2]
يمكن الحصول على المعلومات الأولية حول ثبات المادة في ظل ظروف درجة حرارة محددة خلال الساعات القليلة الأولى. ولتحقيق هذه الغاية، يتم تقييم حركية عملية تحلل المادة (التحلل الحراري، والتحلل الحراري، والتحلل والجفاف) واستخدامها لتحديد سلوكها خلال متساوي الحرارة لفترة طويلة. وهذا يسمح بإجراء الفرز الأولي للمكونات الصيدلانية النشطة/المواد السواغة، بسرعة.
في ما يلي، يتم تحديد حركية تفاعل الجفاف لثنائي هيدروجين فوسفات الكالسيوم ثنائي الهيدروجين CaHPO4-2H2O(يُطلق عليه أيضًا DCP). وللقيام بذلك، يتم استخدام قياسات قياس الثقل الحراري التي يتم إجراؤها بمعدلات تسخين مختلفة لتقييم حركية التفاعل عن طريق برنامج NETZSCH Kinetics Neo.
شروط القياس
DCP عبارة عن مادة حشو تُستخدم عادةً في صناعة الأقراص. وقد تفضلت شركة JRS Pharma (الاسم التجاري: Emcompress®) بتوفير المادة المستخدمة في القياسات. تم تلخيص الظروف التجريبية في الجدول 1.
الجدول 1: شروط الاختبار
الجهاز | TG 209 F1 نيفيو 209 F1 مقترنًا بمقياس الأشعة تحت الحمراء FT-IR من شركة بروكر للبصريات (اقتران PERSEUS® اقتران) | جهاز TG 209 F1 نيفيو |
|---|---|---|
| العينة | DCP Emcompress® (JRS Pharma) | |
| كتلة العينة | 3.71 مجم | 3.71 مجم إلى 4.30 مجم |
| بوتقة | كونكافوس مغلق (آل) بغطاء مثقوب | |
| برنامج درجة الحرارة | 30 درجة مئوية إلى 300 درجة مئوية | |
| معدل التسخين | 10 كلفن/دقيقة | 1 كلفن/دقيقة إلى 20 كلفن/دقيقة |

نتائج القياس
قياس TGA-FT-الأشعة تحت الحمراء على DCP
يعرض الشكل 1 منحنى فقدان الكتلة (باللون الأخضر) ومخطط جرام شميدت (باللون الأسود) الناتج عن قياس TGA-FTIR على DCP. يشير منحنى جرام شميدت إلى نطاقات درجات الحرارة التي تم اكتشاف الغازات المنبعثة فيها. يمكن رؤية ثلاث خطوات لفقدان الكتلة بين درجة حرارة الغرفة و300 درجة مئوية، وهو ما يقابل ثلاث درجات قصوى في مخطط جرام-شميت. تتوافق الكتلة المتبقية المقيسة بنسبة 79% مع الكتلة المتبقية النظرية بعد فقدان 2 H2Oمن DCP.
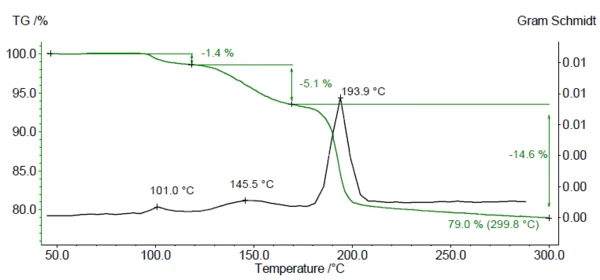
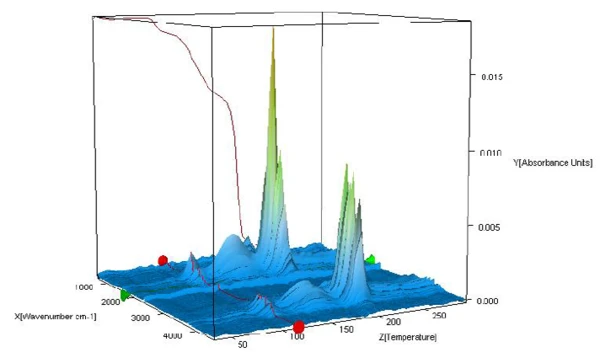
يتم تحليل أطياف FT-IR للنواتج المنطلقة أثناء التسخين للتحقق مما إذا كان الماء فقط أو مكونات أخرى يتم إطلاقها في نطاق درجة الحرارة هذا. يعرض الشكل 2 أطياف FT-IR للمواد المنطلقة أثناء القياس في صورة ثلاثية الأبعاد. ويُظهر استخراج الأطياف عند درجات حرارة مختلفة أن خطوات فقدان الكتلة المكتشفة ترجع فقط إلى تطور الماء (انظر الأشكال 3أ و3ب و3ج، أطياف الأشعة تحت الحمراء للأشعة تحت الحمراء للأشعة فوق البنفسجية للمواد المنطلقة عند 110 درجة مئوية و159 درجة مئوية و205 درجة مئوية وكذلك الشكل 3د، طيف مقارنة الماء من مكتبة وكالة حماية البيئة-نيست).
ومن المعروف من الأدبيات [4] أن الماء السطحي والماء الهيكلي يبدأ في مغادرة التركيب البلوري عند حوالي 80 درجة مئوية، وعند هذه النقطة يبدأ الطور غير المتبلور في التكون. تزداد كمية المادة في الطور غير المتبلور أثناء التحلل حتى 200-220 درجة مئوية وتختلف مع معدل التسخين.
تحليل حركية عملية الجفاف
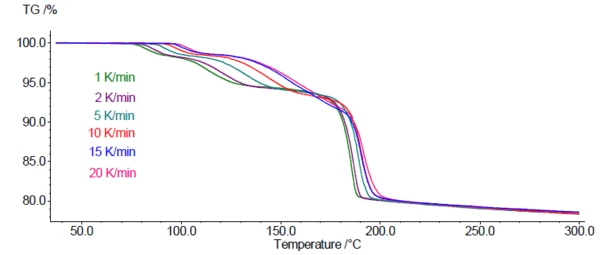
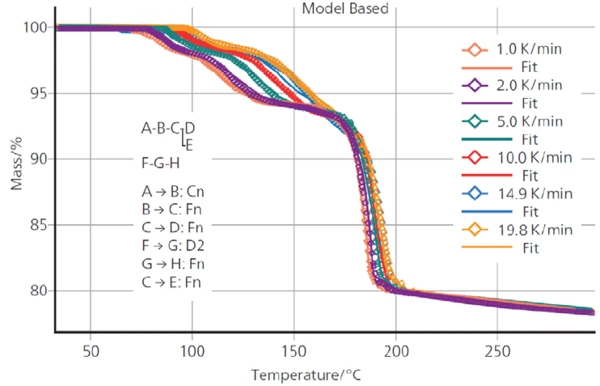
يصور الشكل 4 منحنيات قياس TGA ل DCP عند 6 معدلات تسخين مختلفة تتراوح بين 1 و20 كلفن/الدقيقة. وكما هو متوقع لهذه العملية الحركية، تنتقل خطوات فقدان الكتلة إلى درجات حرارة أعلى مع زيادة معدلات التسخين.
ويسمح هذا الاعتماد لخطوات فقدان الكتلة على معدل التسخين باستخدام منحنيات TGA لتحليل حركية الجفاف. لهذا الغرض، تم استخدام برنامج Kinetics Neo (من شركة NETZSCH-Gerätebau GmbH). ويمكنه تعيين كل خطوة على حدة أنواع مختلفة من التفاعلات مع معلمات حركية خاصة بها، مثل طاقة التنشيط وترتيب التفاعل وعامل ما قبل الأسي. استنادًا إلى النتائج، يستطيع Kinetics Neo محاكاة التفاعل (التفاعلات) لبرامج درجات الحرارة التي يحددها المستخدم، على سبيل المثال، متساوي الحرارة لفترة طويلة عند درجة حرارة محددة.
تساعد الملاحظات التالية في تحديد عدد خطوات الحركية ونوعها.
- يشير وجود ثلاث خطوات لفقدان الكتلة إلى أن العملية تستغرق ثلاث خطوات على الأقل.
- إن حقيقة أن المنحنيات عند معدل تسخين منخفض تتداخل مع المنحنيات عند معدل تسخين مرتفع (انظر نطاق درجة الحرارة من 150 درجة مئوية إلى 190 درجة مئوية) هو مؤشر على أن خطوة التفاعل يجب أن توصف بنموذج تفاعل تنافسي أو متوازي.
- بعد الخطوة الثالثة لفقدان الكتلة، تستمر الكتلة في التناقص؛ ويمكن وصف ذلك بخطوة إضافية في نموذج الحركية.
في النهاية، تم التوصل إلى النموذج التالي لوصف العملية على أفضل وجه:
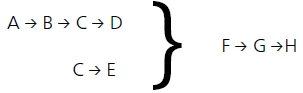
- تصف خطوة التفاعل A → B خطوة فقدان الكتلة الأولى لمنحنى TGA وتأتي من إطلاق الماء السطحي.
خطوات التفاعل
B → C → D
C → E
قد تتوافق مع الخطوات التي وصفها راباتين وآخرون. [3]:
CaHPO4 - 2H2O→ CaHPO4- xH2O+ (2-x)H2O(I)
H2O(I)
مما يؤدي إلى تكوين كميات متكافئة مختلفة من الماء مع CaHPO4 - H2O[الناتج D] وCAHPO4 - yH2O[الناتج E].
بالإضافة إلى ذلك، بدأ تكوين الطور غير المتبلور، والذي يعتمد على معدل التسخين. كلما انخفض معدل التسخين، زادت مدة المرحلة غير المتبلورة. قد تكون الفترات المختلفة للمرحلة غير المتبلورة الناتجة عن معدلات التسخين المختلفة مسؤولة عن قيم TGA مختلفة بعد خطوة التحلل الثانية عند 180 درجة مئوية ومسؤولة عن التحلل بطرق متوازية. في حركية نيو، يتم وصف النواتج D وE مع F (F = D + E). - تتوافق درجة حرارة الكشف عن خطوة فقدان الكتلة الثالثة مع قياس DTA الذي وصفه راباتين وآخرون [3]، حيث تم اكتشاف ذروة عند 195 درجة مئوية. ربط المؤلفون هذه الذروة بالآلية التالية: CaHPO4- xH2O→ CaHPO4 (غير متبلور) + xH2O
وهذا بدوره يرتبط بالخطوة F → G من حركية نيو. - تصف خطوة التفاعل G → H الانخفاض المستمر في الكتلة فوق 200 درجة مئوية.
يوضح الشكل 5 التوافق الجيد بين منحنيات TGA المقاسة وتلك المحسوبة بواسطة Kinetics Neo باستخدام نموذج الحركية الموصوف. ويبلغ معامل الارتباط بين المنحنيات المقاسة والمحسوبة 0.999.
يلخص الجدول 2 معلمات كل خطوة من خطوات التفاعل المحسوبة بواسطة Kinetics Neo.
الجدول 2: البارامترات الحركية لخطوات التفاعل
| خطوة التفاعل | أ → ب | ب → ج | ج → د → د | د → ه | و (د+ه) → ز | ز → ح |
| نوع التفاعل | الرتبة التاسعة مع التحفيز الذاتي | الرتبة التاسعة | الرتبة التاسعة | الرتبة التاسعة | الانتشار | الرتبة التاسعة |
| طاقة التنشيط [كيلو جول-مول-1] | 144.8 | 104.2 | 111.3 | 50.7 | 611.9 | 19.9 |
| لوغاريتم (العامل الأسي المسبق) | 17.9 | 11.5 | 11.9 | 0.5 | 67.2 | 4.1 |
| ترتيب التفاعل | 1.59 | 0.43 | 0.91 | 0.01 | - | 3.17 |
| المساهمة | 0.063 | 0.067 | 0.150 | 0.235 | 0.495 | 0.182 |
من تقييم الحركية إلى تنبؤات سلوك العينة
تسمح معرفة حركية التفاعل بمحاكاة عملية الجفاف لأي برنامج درجة حرارة محدد، بما في ذلك متساوي الحرارة لفترة طويلة.
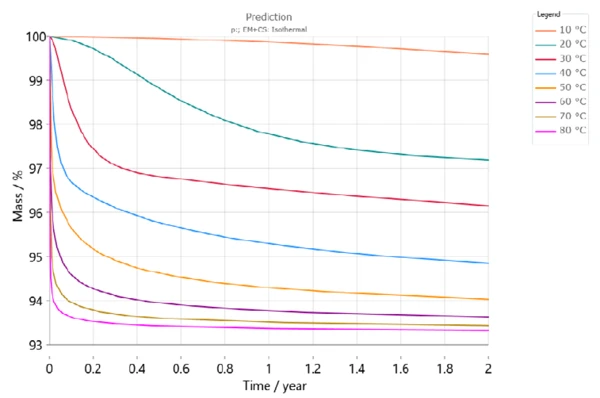
يوضح الشكل 6 جفاف DCP على مدار عامين لدرجات حرارة تخزين مختلفة. ووفقًا لهذه المحاكاة، سيكون هناك فقدان للكتلة بنسبة تزيد عن 3% بعد 6 أشهر عند درجة حرارة تخزين 30 درجة مئوية (المنحنى الأحمر). ومع ذلك، عند درجة حرارة 50 درجة مئوية، سيكون فقدان الكتلة بالفعل أكثر من 5% خلال نفس الفترة (برتقالي فاتح).
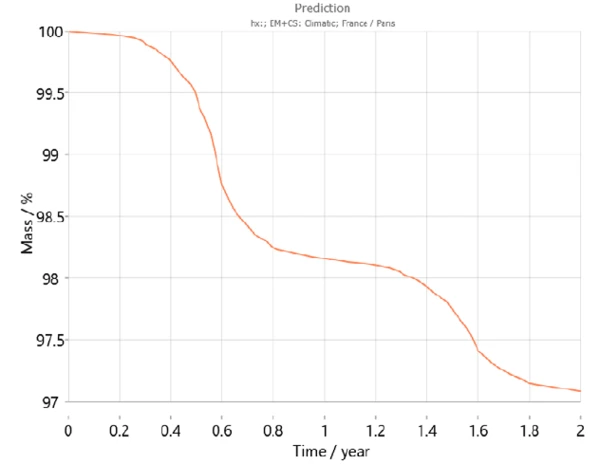
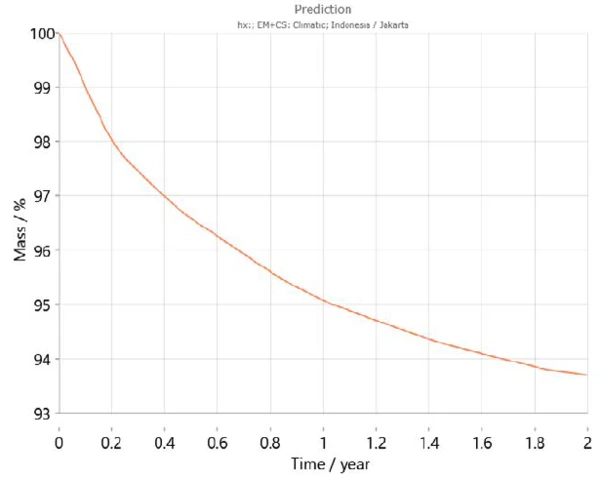
بالإضافة إلى ذلك، يحتوي Kinetics Neo على خريطة مناخية تأخذ في الاعتبار متوسط أنماط درجات الحرارة على مدار السنوات الأخيرة لمختلف مناطق العالم بما في ذلك التغيرات في درجات الحرارة خلال العام. وباستخدام هذه المعلومات، يستطيع Kinetics Neo تكييف تنبؤاته لسلوك العينة لبلد معين. على سبيل المثال، يُظهر الشكلان 7 و8 منحنيات التنبؤ لثنائي هيدروجين فوسفات الكالسيوم على مدار عامين في باريس (فرنسا) وجاكرتا (إندونيسيا) على التوالي. كما هو متوقع، يختلف سلوك العينة اختلافًا كبيرًا بين المدينتين. حيث يعمل الجفاف بشكل أسرع في جاكرتا بسبب ارتفاع درجات الحرارة مقارنةً بدرجات الحرارة في باريس.
الخاتمة
يُعد الجمع بين قياس الثبات الحراري وحركية نيو أداة قوية للحصول على معلومات أولية حول ثبات المادة لدرجات حرارة تخزين محددة.
يمكن استخدامه لفحص المكونات الصيدلانية النشطة (المكونات الصيدلانية الفعالة) والسواغات أثناء تطوير منتج صيدلاني جديد من أجل إجراء اختيار مسبق لدراسات الثبات لفترات أطول.