Einleitung
Die Stabilität von pharmazeutischen Wirkstoffen und Hilfsstoffen steht in direktem Zusammenhang mit ihren Lagerbedingungen: Eine Lagerung bei ungeeigneter Temperatur (zu warm oder zu kalt) kann ihre Wirksamkeit, Sicherheit und Haltbarkeit beeinflussen. Die in den WHO (World Health Organization)- und ICH-(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) Richtlinien beschriebenen Untersuchungen zur pharmazeutischen Lagerstabilität gehen von einer minimalen Testzeit von 6 Monaten aus. [1, 2]
Erste Informationen über die Stabilität einer Substanz unter bestimmten Temperaturbedingungen lassen sich innerhalb weniger Stunden gewinnen. Dafür wird die Kinetik des Abbauprozesses der Substanz (thermische Zersetzung, Desolvatisierung, Dehydratation) ausgewertet und zur Bestimmung des Verhaltens bei Langzeitisothermen herangezogen. Auf diese Weise kann eine erste Sortierung von Wirkstoffen/Hilfsstoffen schnell durchgeführt werden.
Im Folgenden wird die Kinetik der Wasserabgabe für Calciumhydrogenphosphat-Dihydrat, CaHPO4·2H2O (auch bezeichnet als DCP), ermittelt. Dazu werden thermogravimetrische Messungen mit unterschiedlichen Aufheizraten durchgeführt, um die Rekationskinetik mit Hilfe der NETZSCH-Software Kinetics Neo auszuwerten.
Messbedingen
DCP ist ein Füllstoff, der für gewöhnlich bei der Tablettierung eingesetzt wird. Die für die Messung verwendete Substanz (Handelsname: Emcompress®) wurde uns freundlicherweise von JRS Pharma zur Verfügung gestellt.
Die Messbedingungen sind in Tabelle 1 zusammengefasst.
Tabelle 1: Messbedingungen
Gerät | TG 209 F1 Nevio, gekoppelt an ein FT-IRSpektrometer von Bruker Optik (PERSEUS®-Kopplung) | TG 209 F1 Nevio |
|---|---|---|
| Probe | DCP Emcompress® (JRS Pharma) | |
| Probeneinwaage | 3,71 mg | 3,71 mg bis 4,30 mg |
| Tiegel | geschlossener Concavus® (Al) mit gelochtem Deckel | |
| Temperaturprogramm | 30 °C bis 300 °C | |
| Heizrate | 10 K/min | 1 K/min bis 20 K/min |

Messergebnisse
TG-FT-IR-Messungen an DCP
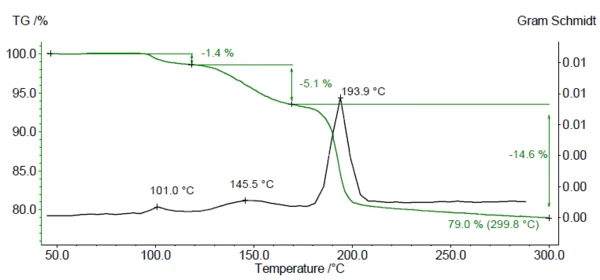
In Abbildung 1 ist die Massenverlustkurve (grün) und der Gram Schmidt-Plot (schwarz) der TG-FT-IR Messung an DCP dargestellt. Die Gram Schmidt-Kurve zeigt die Temperaturbereiche an, in denen freigesetzte Gase nachgewiesen wurden. Zwischen Raumtemperatur und 300 °C sind drei Massenverluststufen zu beobachten, die den drei Maxima im Gram Schmidt-Plot entsprechen. Die gemessene Restmasse von 79 % entspricht der theoretischen Restmasse nach dem Verlust von 2 H2O des Calciumhydrogenphosphat-Dihydrats.
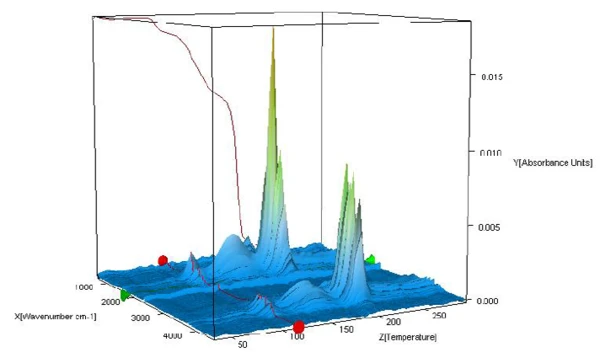
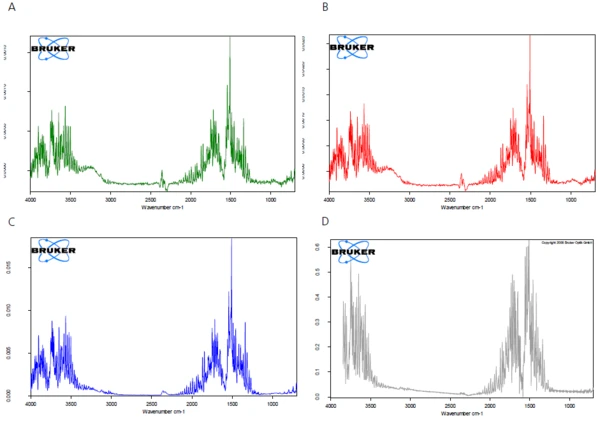
Die FT-IR-Spektren der während der Aufheizung freigesetzten Produkte werden analyisert, um zu überprüfen, ob in diesem Temperaturbereich nur Wasser oder aber auch weitere Komponenten freigesetzt wurden. Abbildung 2 stellt die FT-IR-Spektren der bei der Messung freigesetzten Substanzen in dreidimensionaler Ansicht dar. Die Extraktion der Spektren bei verschiedenen Temperaturen zeigt, dass die detektierten Massenverluststufen nur auf die Abspaltung von Wasser zurückzuführen sind (siehe Abbildungen 3A, 3B und 3C, FT-IR-Spektren der bei 110 °C, 159 °C und 205 °C freigesetzten Substanzen sowie 3D, Wasservergleichsspektrum aus der EPA-NIST-Bibliothek).
Wie aus der Literatur [4] bekannt ist, beginnt das Oberflächen- und Strukturwasser bei ca. 80 °C die Kristallstruktur zu verlassen, wobei die Bildung einer amorphen Phase einsetzt. Die Menge der Substanz in der amorphen Phase steigt während der Zersetzung bis 200 °C - 220 °C an und verändert sich mit der Heizrate.
Kinetikanalyse des Dehydratationsprozesses
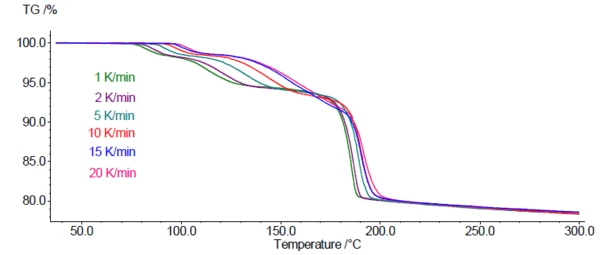
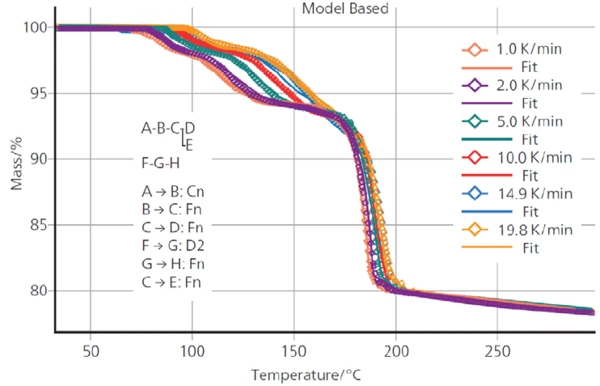
Abbildung 4 stellt die TG-Messkurven für DCP mit 6 unterschiedlichen Heizraten zwischen 1 und 20 K/min dar. Wie bei diesem kinetischen Prozess zu erwarten ist, sind die Massenverluststufen mit zunehmender Heizrate zu höheren Temperaturen verschoben.
Diese Abhängigkeit der Massenverluststufen von der Heizrate ermöglicht die Verwendung von TG-Kurven für eine kinetische Analyse der Dehydratation. Dazu wurde die Software Kinetics Neo Software (von NETZSCH-Gerätebau GmbH) angewandt. Sie kann jeder einzelnen Stufe verschiedene Reaktionstypen mit eigenen kinetischen Parametern wie Aktivierungsenergie, Reaktionsordnung und Präexponentialfaktor zuordnen. Basierend auf den Ergebnissen kann Kinetics Neo die Reaktion(en) für anwenderspezifische Temperaturprogramme, z.B. Langzeitisothermen bei einer bestimmten Temperatur, simulieren.
Folgende Beobachtungen helfen bei der Bestimmung von Anzahl und Typ der kinetischen Stufen.
- Das Auftreten von drei Massenverluststufen zeigt an, dass der Prozess über mindestens drei Stufen verläuft.
- Die Tatsache, dass die Kurven mit niedriger Heizrate die Kurven mit hoher Heizrate schneiden (siehe Temperaturbereich von 150 °C bis 190 °C ) ist ein Hinweis darauf, dass eine Reaktionsstufe durch ein konkurierendes oder paralleles Reaktionsmodell beschrieben werden sollte.
- Nach der dritten Massenverluststufe nimmt die Masse weiter ab; dies kann durch eine weitere Stufe im Kinetikmodell beschrieben werden.
Letztendlich wurde folgendes Modell gefunden, dass den Prozess am besten beschreibt:
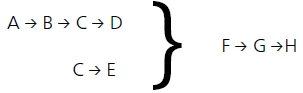
- Die Reaktionsstufe A → B beschreibt die erste Massenverluststufe der TG-Kurve und ist auf die Freisetzung von Oberflächenwasser zurückzuführen.
- Die Reaktionsstufe
B → C → D
C → E
kann den von Rabatin et al. [3] beschriebenen Stufen entsprechen:
CaHPO4 · 2H2O → CaHPO4·xH2O + (2-x)H2O(I)
H2O(I) → H2O(g)
was zur Bildung von unterschiedlichen stöchiometrischen
Wasseranteilen mit CaHPO4 · H2O [Product D] und CaHPO4 · yH2O [Product E] führt. - Zusätzlich hat die Bildung der amorphen Phase eingesetzt, die von der Heizrate abhängt. Je geringer die Heizrate, desto länger bleibt die amorphe Phase bestehen. Unterschiedlich lange amorphe Phasen, die sich aus den verschiedenen Heizraten ergeben, können für unterschiedliche TG-Werte nach der zweiten Zersetzungsstufe bei 180 °C und parallel für die Zersetzung verantwortlich sein.
In Kinetics Neo werden die Produkte D und E mit F (F = D + E) beschrieben. - Die Temperatur, bei der die dritte Massenverluststufe detektiert wurde, stimmt mit der von Rabatin et al. [3] beschriebenen DTA-Messung überein, bei der ein Peak bei 195 °C nachgewiesen wurde. Die Autoren assoziierten diesen Peak mit folgendem Mechanismus:
CaHPO4 · xH2O → CaHPO4 (amorph) + xH2O
Dies wiederum korreliert mit der Stufe
F → G von Kinetics Neo. - Die Reaktionsstufe G →H beschreibt die kontinuierliche Massenabnahme oberhalb von 200 °C.
Abbildung 5 zeigt die gute Übereinstimmung der gemessenen TG-Kurven und der mittels Kinetics Neo unter Verwendung des beschriebenen Kinetikmodells berechneten Kurven. Der Korrelationskoeffizient zwischen den gemessenen und berechneten Kurven beläuft sich auf 0,999.
Die Parameter jeder mittels Kinetics Neo berechneten Reaktionsstufe sind in Tabelle 2 zusammengefasst.
Tabelle 2: Kinetische Parameter der Reaktionsstufen
| Reaktionssstufe | A → B | B → C | C → D | D → E | F (D+E) → G | G → H |
| Reaktionstyp | n-te Ordnung mit Autokatalyse | n-te-Ordnung | n-te-Ordnung | n-te-Ordnung | Diffusion | n-te-Ordnung |
| Aktivierungsenergie [kJ·mol-1] | 144,8 | 104,2 | 111,3 | 50,7 | 611,9 | 19,9 |
| Log (Präexponentialfaktor) | 17,9 | 11,5 | 11,9 | 0,5 | 67,2 | 4,1 |
| Reaktionsordnung | 1,59 | 0,43 | 0,91 | 0,01 | - | 3,17 |
Von der Kinetikauswertung zur Vorhersage des Probenverhaltens
Die Kenntnis der Reaktionskinetik erlaubt die Simulation des Dehydrationsprozesses für beliebig ausgewählte Temperaturprogramme, einschl. Langzeit-Isothermen.
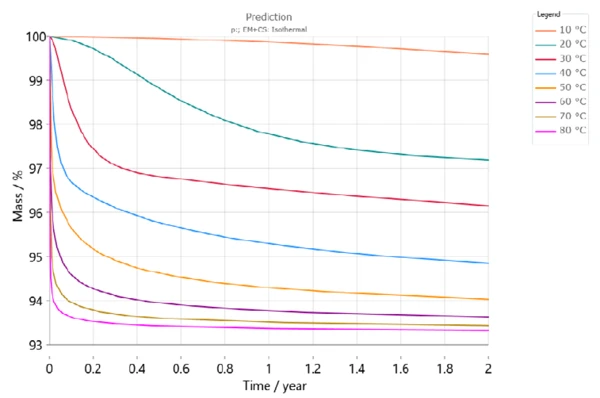
Abbildung 6 zeigt die Dehydratation von DCP über einen Zeitraum von zwei Jahren bei unterschiedlichen Lagertemperaturen. Gemäß dieser Simulation ergibt sich nach 6 Monaten bei einer Lagertemperatur von 30 °C (rote Kurve) ein Massenverlust von mehr als 3 %. Bei 50 °C wird der Massenverlust im gleichen Zeitraum jedoch bereits mehr als 5 % betragen (hellorange Kurve).
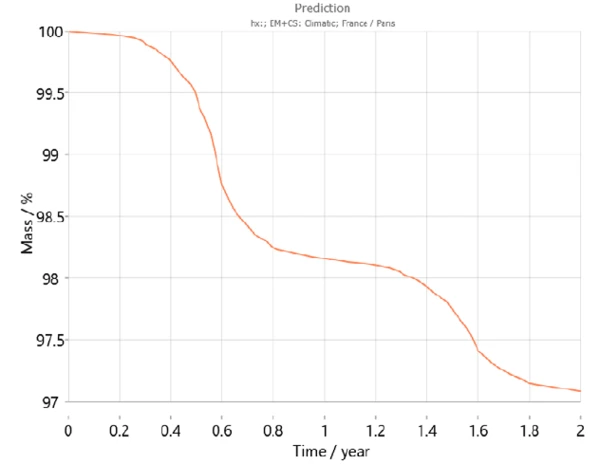
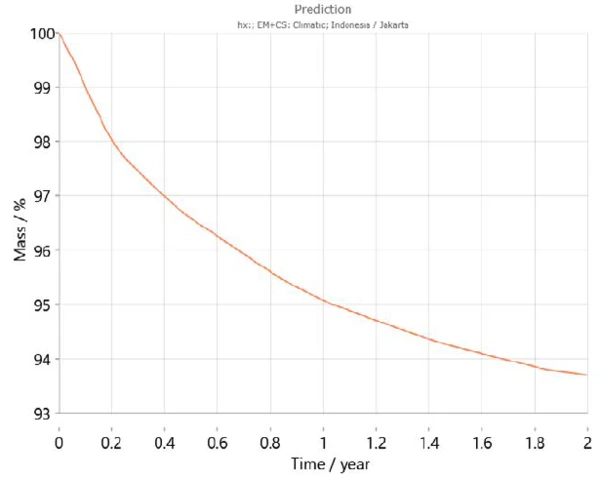
Zusätzlich beinhaltet Kinetics Neo eine Klimakarte, die die durchschnittlichen Temperaturverläufe der letzten Jahre für die verschiedenen Regionen der Welt einschließlich der Temperaturschwankungen während des Jahres berücksichtigt. Aufgrund dieser Informationen ist Kinetics Neo in der Lage, die Vorhersage des Probenverhaltens für ein bestimmtes Land anzupassen. So zeigen Abbildungen 7 und 8 beispielsweise die Vorhersagekurven für Calciumhydrogenphosphat-Dihydrat über zwei Jahre in Paris (Frankreich) bzw. Jakarta (Indonesien). Erwartungsgemäß unterscheidet sich das Verhalten der Proben zwischen den beiden Städten sehr stark. Die Dehydratation verläuft in Jakarta aufgrund der höheren Temperaturen im Vergleich zu Paris schneller.
Zusammenfassung
Die Kombination von Thermogravimetrie und Kinetics Neo ist ein leistungsfähiges Werkzeug, um erste Informationen über die Haltbarkeit einer Substanz bei bestimmten Lagertemperaturen zu erhalten.
Sie kann für das Screening von pharmazeutischen Wirkstoffen und Hilfsstoffen während der Entwicklung eines neuen pharmazeutischen Produkts eingesetzt werden, um eine Vorauswahl für Stabilitätsstudien von längerer Dauer zu treffen.