Giriş
API'lerin (aktif farmasötik bileşenler) ve yardımcı maddelerin stabilitesi saklama koşulları ile doğrudan ilişkilidir: Uygun olmayan bir sıcaklıkta (çok sıcak veya çok soğuk) depolanmaları etkinliklerini, güvenliklerini ve raf ömürlerini etkileyebilir. WHO (Dünya Sağlık Örgütü) ve ICH (Beşeri Kullanım için Teknik Gerekliliklerin Uyumlaştırılması Uluslararası Konseyi) kılavuzlarında açıklanan farmasötik depolama stabilitesi testlerinin tamamlanması için en az 6 ay gerekmektedir. [1, 2]
Belirli sıcaklık koşulları altında bir maddenin kararlılığı hakkında ilk bilgiler ilk birkaç saat içinde elde edilebilir. Bu amaçla, maddenin bozunma sürecinin kinetiği (termal Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma, desolvasyon, dehidrasyon) değerlendirilir ve uzun süreli izotermler sırasında davranışını belirlemek için kullanılır. Bu, API'lerin/eksipiyanların ilk sınıflandırmasının hızlı bir şekilde yapılmasını sağlar.
Aşağıda, kalsiyum hidrojen fosfat dihidrat, CaHPO4-2H2O(DCP olarak da adlandırılır) için dehidrasyon reaksiyonunun kinetiği belirlenmiştir. Bunu yapmak için, farklı ısıtma hızlarında gerçekleştirilen termogravimetrik ölçümler, NETZSCH Kinetics Neo yazılımı aracılığıyla reaksiyon kinetiğini değerlendirmek için kullanılır.
Ölçüm Koşulları
DCP, tabletleme için yaygın olarak kullanılan bir dolgu maddesidir. Ölçümler için kullanılan madde JRS Pharma tarafından sağlanmıştır (ticari adı: Emcompress®). Deneysel koşullar Tablo 1'de özetlenmiştir.
Tablo 1: Test koşulları
Cihaz | TG 209 F1 Nevio FT-IR ile birleştirilmiş bruker Optics'ten spektrometre (PERSEUS® birleştirme) | TG 209 F1 Nevio |
|---|---|---|
| Örnek | DCP Emcompress® (JRS Pharma) | |
| Örnek kütle | 3.71 mg | 3.71 mg ila 4,30 mg |
| Pota | Kapalı Concavus® (Al) delikli kapaklı | |
| Sıcaklık programı | 30°C ila 300°C | |
| Isıtma oranı | 10 K/dak | 1 K/dak ila 20 K/dak |

Ölçüm Sonuçları
DCP üzerinde TGA-FT-IR Ölçümü
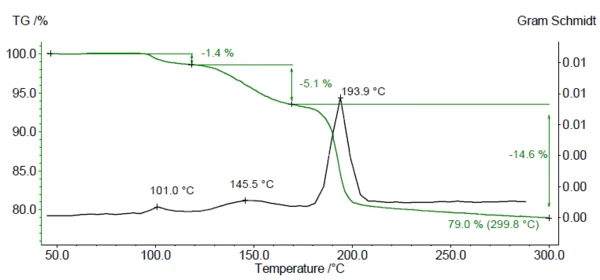
Şekil 1, DCP üzerinde TGA-FTIR ölçümünden elde edilen kütle kaybı eğrisini (yeşil) ve Gram Schmidt grafiğini (siyah) göstermektedir. Gram Schmidt eğrisi, salınan gazların tespit edildiği sıcaklık aralıklarını göstermektedir. Oda sıcaklığı ile 300°C arasında Gram-Schmidt grafiğinde üç maksimuma karşılık gelen üç kütle kaybı adımı görülmektedir. Ölçülen %79'luk kalıntı kütle, DCP'den 2H2Okaybından sonraki teorik kalıntı kütleye karşılık gelmektedir.
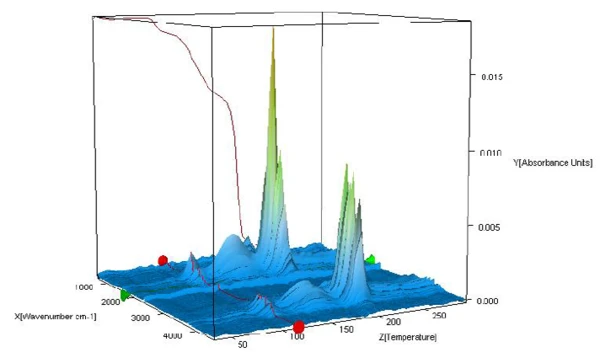
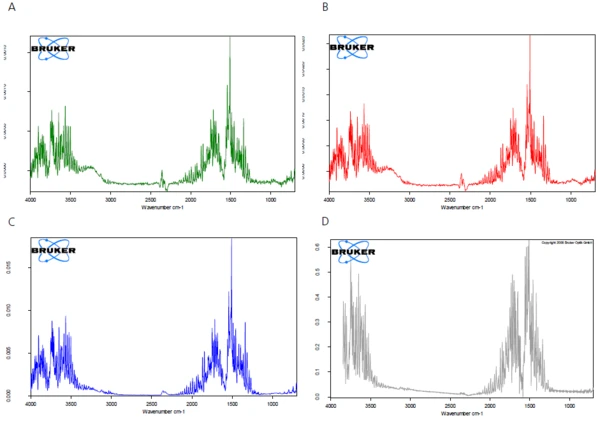
Isıtma sırasında açığa çıkan ürünlerin FT-IR spektrumları, bu sıcaklık aralığında sadece suyun mu yoksa başka bileşenlerin de açığa çıkıp çıkmadığını kontrol etmek için analiz edilir. Şekil 2, ölçüm sırasında açığa çıkan maddelerin FT-IR spektrumlarını üç boyutlu bir görünüm olarak göstermektedir. Spektrumların farklı sıcaklıklarda çıkarılması, tespit edilen kütle kaybı adımlarının yalnızca suyun evrimleşmesinden kaynaklandığını göstermektedir (bkz. şekil 3A, 3B ve 3C, 110°C, 159°C ve 205°C'de salınan maddelerin FT-IR spektrumları ve 3D, EPA-NIST library'den su karşılaştırma spektrumu).
Literatürden [4] yüzey suyu ve yapısal suyun 80°C civarında kristal yapıyı terk etmeye başladığı ve bu noktada amorf bir fazın oluşmaya başladığı bilinmektedir. Amorf fazdaki madde miktarı Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma sırasında 200-220°C'ye kadar artar ve ısıtma hızına göre değişir.
Dehidrasyon Sürecinin Kinetik Analizi
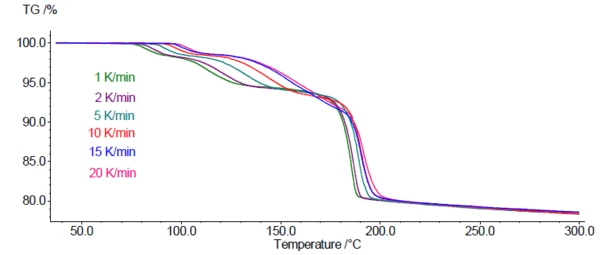
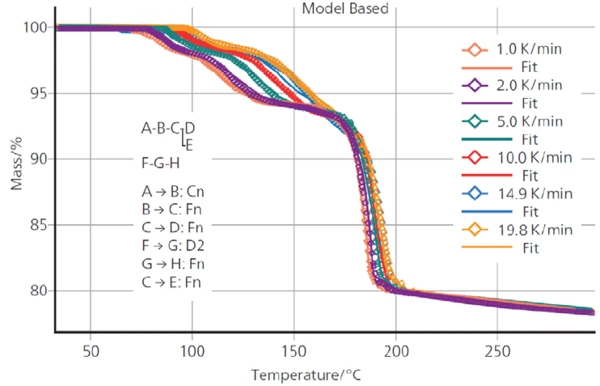
Şekil 4'te DCP için 1 ila 20 K/dak arasında 6 farklı ısıtma hızında TGA ölçüm eğrileri gösterilmektedir. Bu kinetik süreç için beklendiği gibi, kütle kaybı adımları artan ısıtma hızlarıyla birlikte daha yüksek sıcaklıklara kaymaktadır.
Kütle kaybı adımlarının ısıtma hızına olan bu bağımlılığı, dehidrasyonun kinetik analizi için TGA eğrilerinin kullanılmasına olanak tanır. Bunun için Kinetics Neo yazılımı ( NETZSCH-Gerätebau GmbH tarafından) kullanılmıştır. Yazılım, her bir adıma aktivasyon enerjisi, reaksiyon sırası ve ön-eksponansiyel faktör gibi kendi kinetik parametrelerine sahip farklı reaksiyon türleri atayabilmektedir. Sonuçlara dayanarak, Kinetics Neo kullanıcı tarafından belirlenen sıcaklık programları için reaksiyon(lar)ı simüle edebilir, örneğin, belirli bir sıcaklıkta uzun süreli izotermler.
Aşağıdaki gözlemler kinetik adımların sayısını ve türünü belirlemeye yardımcı olur.
- Üç kütle kaybı adımının varlığı, sürecin en az üç adım boyunca ilerlediğini göstermektedir.
- Düşük ısıtma hızındaki eğrilerin yüksek ısıtma hızındaki eğrilerle kesişmesi (bkz. 150°C-190°C sıcaklık aralığı), bir reaksiyon adımının rekabetçi veya paralel reaksiyon modeliyle tanımlanması gerektiğinin bir göstergesidir.
- Üçüncü kütle kaybı adımından sonra kütle azalmaya devam eder; bu, kinetik modelde ek bir adımla açıklanabilir.
Sonuçta, aşağıdaki modelin süreci en iyi şekilde tanımladığı görülmüştür:
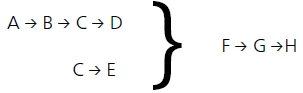
- A → B reaksiyon adımı, TGA eğrisinin ilk kütle kaybı adımını tanımlar ve yüzey suyunun salınmasından kaynaklanır.
B → C → D
C → E
reaksiyon adımları, Rabatin ve diğerleri tarafından açıklanan adımlara karşılık gelebilir. [3]:
CaHPO4 - 2H2O→ CaHPO4- xH2O+ (2-x)H2O(I)
H2O(I) → H2O(g)
CaHPO4 -H2O[ürün D] ve CaHPO4 - yH2O[ürün E] ile farklı stokiyometrik miktarlarda su oluşumuna yol açar.
Ayrıca, ısıtma hızına bağlı olarak amorf faz oluşumu başlamıştır. Isıtma hızı ne kadar düşük olursa, amorf fazın süresi de o kadar uzun olur. Farklı ısıtma hızlarından kaynaklanan amorf fazın farklı süreleri, 180°C'deki ikinci Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma adımından sonra farklı TGA değerlerinden sorumlu olabilir ve paralel yollarla ayrışmadan sorumlu olabilir. Kinetik Neo'da D ve E ürünleri F ile tanımlanır (F = D + E). - Üçüncü kütle kaybı adımının tespit sıcaklığı, 195°C'de bir pikin tespit edildiği Rabatin ve diğerleri [3] tarafından açıklanan DTA-ölçümü ile tutarlıdır. Yazarlar bu piki aşağıdaki mekanizma ile ilişkilendirmişlerdir: CaHPO4- xH2O→ CaHPO4 (amorf) + xH2O
Bu da Kinetik Neo'daki F → G adımı ile ilişkilendirilmiştir. - G → H reaksiyon adımı, 200°C'nin üzerindeki sürekli kütle azalmasını tanımlar.
Şekil 5, ölçülen TGA eğrileri ile tanımlanan kinetik model kullanılarak Kinetics Neo tarafından hesaplananlar arasındaki iyi uyumu göstermektedir. Ölçülen ve hesaplanan eğriler arasındaki korelasyon katsayısı 0,999'dur.
Kinetics Neo tarafından hesaplanan her bir reaksiyon adımının parametreleri Tablo 2'de özetlenmiştir.
Tablo 2: Reaksiyon adımlarının kinetik parametreleri
| Reaksiyon adımı | A → B | B → C | C → D | D → E | F (D+E) → G | G → H |
| Reaksiyon tipi | ile n. dereceden otokataliz | n 'inci derece | n 'inci derece | n 'inci derece | difüzyon | n 'inci derece |
| Aktivasyon enerjisi [kJ-mol-1] | 144.8 | 104.2 | 111.3 | 50.7 | 611.9 | 19.9 |
| Log (üssel faktör öncesi) | 17.9 | 11.5 | 11.9 | 0.5 | 67.2 | 4.1 |
| Reaksiyon düzeni | 1.59 | 0.43 | 0.91 | 0.01 | - | 3.17 |
| Katkı | 0.063 | 0.067 | 0.150 | 0.235 | 0.495 | 0.182 |
Kinetik Değerlendirmeden Örnek Davranış Tahminlerine
Reaksiyon kinetiğinin bilinmesi, uzun süreli izotermler de dahil olmak üzere herhangi bir selected sıcaklık programı için dehidrasyon sürecinin simüle edilmesini sağlar.
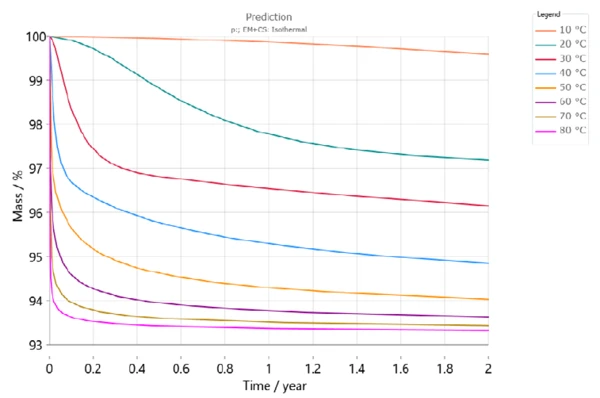
Şekil 6, farklı depolama sıcaklıkları için DCP'nin iki yıl boyunca dehidrasyonunu göstermektedir. Bu simülasyona göre, 30°C depolama sıcaklığında 6 ay sonra %3'ten fazla bir kütle kaybı olacaktır (kırmızı eğri). Ancak 50°C'de kütle kaybı aynı süre içinde %5'ten fazla olacaktır (açık turuncu).
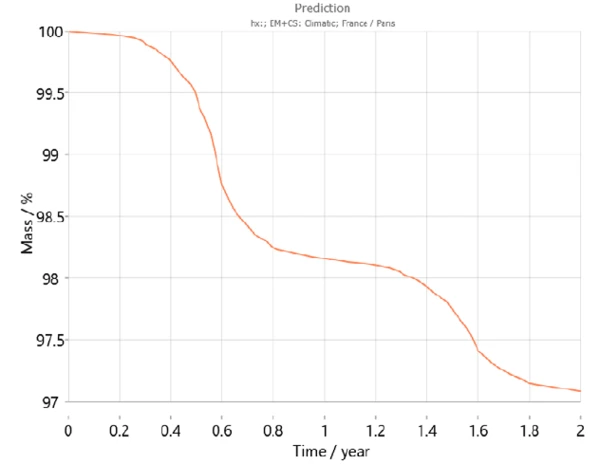
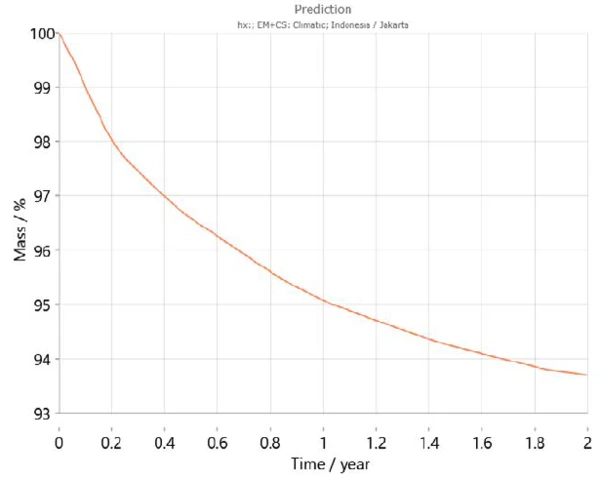
Ayrıca Kinetics Neo, yıl içindeki sıcaklık değişimleri de dahil olmak üzere dünyanın farklı bölgeleri için son yıllardaki ortalama sıcaklık modellerini dikkate alan bir iklim haritası içerir. Bu bilgileri kullanarak Kinetics Neo, belirli bir ülke için örnek davranış tahminini uyarlayabilmektedir. Örneğin, Şekil 7 ve 8 sırasıyla Paris (Fransa) ve Jakarta'da (Endonezya) iki yıl boyunca kalsiyum hidrojen fosfat dihidrat için tahmin eğrilerini göstermektedir. Beklendiği gibi, numunenin davranışı iki şehir arasında büyük farklılıklar göstermektedir. Cakarta'da dehidrasyon Paris'tekine kıyasla daha yüksek sıcaklıklar nedeniyle daha hızlı gerçekleşmektedir.
Sonuç
Termogravimetri ve Kinetik Neo kombinasyonu, belirli depolama sıcaklıkları için bir maddenin stabilitesi hakkında ilk bilgileri elde etmek için güçlü bir araçtır.
Yeni bir farmasötik ürünün geliştirilmesi sırasında API'lerin (aktif farmasötik bileşenler) ve yardımcı maddelerin taranması için, daha uzun süreli stabilite çalışmaları için bir önselectiyon yapmak amacıyla kullanılabilir.