مقدمة

في حين أن التقنيات التحليلية مثل EDX أو ICP-MS توفر تحليلًا تفصيليًا للعناصر الكيميائية، على سبيل المثال، للعناصر الموجودة في عينة الملح [1]، يمكن استخدام طرق التحليل الحراري أيضًا لتحديد وتوصيف المركبات الكيميائية المختلفة الموجودة في مثل هذه العينة. على سبيل المثال، تم استخدام التحليل الحراري المتزامن (STA)، الذي يشير إلى قياس الثقل الحراري (TGA) وقياس المسعر بالمسح التفاضلي (DSC) الذي يتم إجراؤه في وقت واحد في تجربة واحدة، على سبيل المثال، لدراسة المواد الخام الأسمنتية بما في ذلك وجود وتأثير شوائب ملح الفلزات القلوية [2]. ومن الأمثلة الأخرى عملية الانصهار والسعة الحرارية النوعية لمادة تغير الطور (PCM) نترات الصوديوم، NaNO3، والتي تمت دراستها عن طريق DSC [3].
يتناول هذا العمل قياسات السعة الحرارية النوعية على كل من كلوريد الصوديوم وكلوريد الكالسيوم وملح الطعام المعتاد وما يسمى بملح الهيمالايا حيث يتم التركيز على الذوبان والتبخر الجزئي والتحليل التركيبي للأملاح. تلعب الأملاح القلوية مثل NaCl (الهاليت) و KCl (السيلفيت) دورًا مهمًا في حياتنا اليومية. ففي حين أن كلوريد الصوديوم هو المكون الرئيسي في ملح الطعام أو ملح الطعام، يمكن استخدام كلوريد الكالسيوم على سبيل المثال كملح طرق في الشتاء. ملح الهيمالايا الذي يأتي من باكستان هو ملح طبيعي يحتوي - إلى جانب كلوريد الصوديوم - على العديد من المعادن والأكاسيد مثل Fe2O3 [1]، وهو المسؤول عن اللون الوردي قليلاً (انظر الصورة أعلاه).
تجريبي
تم إجراء القياسات باستخدام STA 449 F5 Jupiter® (انظر الشكل 1). يمكن تجهيز هذه الأداة، التي تحتوي على فرن سيليكوني يسمح بدرجة حرارة قصوى للعينة تبلغ 1600 درجة مئوية، اختياريًا بمغير العينة الأوتوماتيكي (ASC) وتقنيات اقتران لتحليل الغازات المتطورة مثل MS أو FT-IR أو GC-MS. يصل نطاق وزن الميزان إلى 35 جرامًا مع دقة ميزان تبلغ 0.1 ميكروجرام على كامل النطاق. ومن المزايا الأخرى للميزان STA 449 F5 Jupiter® وظيفة برنامج TG-BeFlat® التي تأخذ تأثير الطفو تلقائيًا في الاعتبار بحيث لا تكون قياسات خط الأساس ضرورية للاختبارات القياسية.

يلخص الجدول 1 شروط القياس المطبقة في هذا العمل.
الجدول 1: شروط القياس المطبقة في هذا العمل
شروط القياس | |
|---|---|
| الجهاز | STA 449 F5 جوبيتر |
| حامل العينة | TGA-DSC من النوع S |
| البوتقات | PtRh (0.19 مل) |
| معدل التسخين | 10 كلفن/دقيقة |
| كتل العينة | 23 ± 1 مجم |
| الغلاف الجوي | N2 |
| معدل تدفق غاز التطهير | 70 مل/دقيقة |
كانت نسبة النقاء الاسمية لكل من عينتي NaCl [4] وKCl [5] 99.8% بينما لم تتوفر أي معلومات عن نقاء ملح الطعام وملح الهيمالايا. تم قياس جميع العينات كطبقة رقيقة من الحبيبات التي تغطي قاع البوتقة فقط؛ ولم تكن مادة العينة مطحونة أو مضغوطة.
النتائج والمناقشة
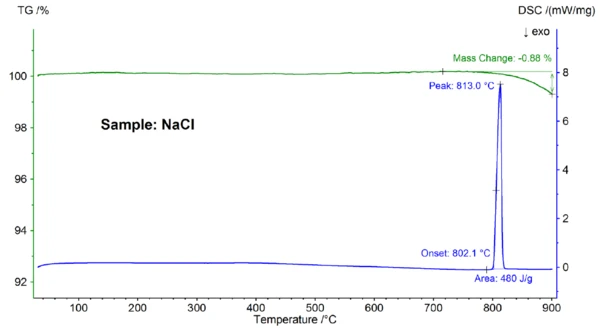
يظهر في الشكل 2 التغير في الكتلة المعتمد على درجة الحرارة ومعدل التدفق الحراري لعينة كلوريد الصوديوم. عند درجة حرارة بداية استقرائية تبلغ 802.1 درجة مئوية، لوحظ تأثير ماص للحرارة مع درجة حرارة قصوى تبلغ 813 درجة مئوية وإنثالبي 480 جول/غرام، وهو ما يمكن أن يُعزى إلى ذوبان العينة. تتطابق درجة حرارة البداية، التي تعكس نقطة الانصهار، بشكل جيد مع القيمة الأدبية البالغة 801 درجة مئوية؛ كما أن الإنثالبي 480 جول/ز تتفق بشكل جيد مع قيمة حرارة الانصهار البالغة 484 جول/ز الموجودة في الأدبيات [6]. وفوق 800 درجة مئوية تقريبًا، حدث فقدان في الكتلة بنسبة 0.9%، وهو ما يرجع إلى التبخر الجزئي للعينة.
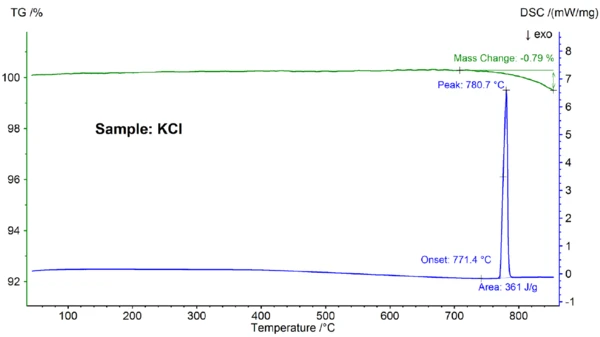
يوضح الشكل 3 نتائج التحاليل الجزيئية لعينة كلوريد الكالسيوم. ومرة أخرى، لوحظ حدوث ذوبان وتبخر جزئي؛ وتتفق درجة الانصهار التي تم اكتشافها عند 771.4 درجة مئوية مع القيمة الأدبية البالغة 772 درجة مئوية، وتتفق قيمة الإنثالبي البالغة 361 جول/غرام مرة أخرى مع القيمة 351 جول/غرام المذكورة في المرجع [6].
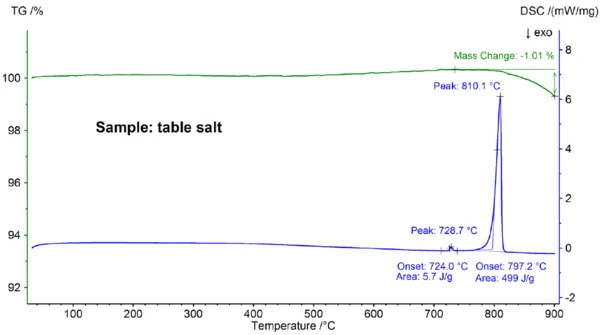
وتظهر في الشكل 4 نتائج STA التي تم الحصول عليها لعينة ملح الطعام، والتي تختلف بوضوح عن النتائج التي تم الحصول عليها لعينة كلوريد الصوديوم النقي (قارن بين الشكلين 4 و2): تبلغ بداية ذروة الذوبان الحراري المانع للحرارة الرئيسية عند درجة حرارة 797.2 درجة مئوية، وبالتالي فهي أقل بكثير من القيمة 802.1 درجة مئوية التي لوحظت في كلوريد الصوديوم النقي؛ كما تم اكتشاف تأثير ماص للحرارة إضافي عند درجة حرارة بداية استقرائية تبلغ 724 درجة مئوية. إن إنثالبي التأثير الرئيسي للذوبان البالغ 499 جول/غم هو في نفس نطاق القيمة 480 جول/غم التي لوحظت لكلوريد الصوديوم النقي، في حين أن إنثالبي التأثير الأول هو 6 جول/غم فقط. تُظهر هذه النتائج أن ملح الطعام - كما هو متوقع - ليس كلوريد الصوديوم النقي؛ حيث إن منحنى DSC الموجود لعينة ملح الطعام يُلاحظ عادةً لمخاليط الأملاح الثنائية [7]. في هذه الحالة، يكون NaI-NaCl بتركيز NaI في نطاق النسبة المئوية الأقل هو المرشح الأكثر احتمالًا [7].
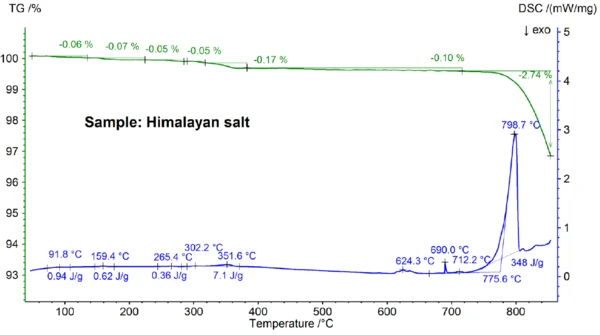
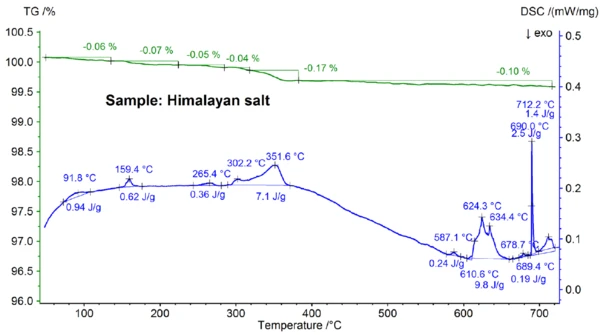
تعتبر نتائج STA التي تم الحصول عليها لملح الهيمالايا الموضحة في الشكلين 5 أ و5 ب أكثر تعقيدًا من نتائج ملح الطعام. ويمكن ملاحظة ذلك بالفعل في خطوات فقدان الكتلة بنسبة 0.06% و0.07% و0.05% و0.05% و0.05% و0.17% و0.10% التي لوحظت تحت 700 درجة مئوية فقط لعينة ملح الهيمالايا (انظر الشكل 5ب). وتحت حوالي 400 درجة مئوية تقريبًا، أظهرت إشارة DSC تأثيرات ماصة للحرارة مرتبطة - والتي ترجع إلى خطوات فقدان الكتلة، ويمكن رؤية التفاصيل مثل درجات حرارة الذروة والإنثالبي في الشكل 5ب. ويرجع فقدان الكتلة تحت درجة حرارة 200 درجة مئوية تقريبًا إلى إطلاق الرطوبة وجفاف الجبس (خليط من CaSO4 ∙2H2OوCaSO4∙H2O) بتركيز يقدر في نطاق دون النسبة المئوية. بين حوالي 200 درجة مئوية و400 درجة مئوية، يمكن أن تكون خطوات فقدان الكتلة ناتجة عن تحلل الكربونات المختلفة بينما يمكن أن تكون خطوة فقدان الكتلة في نطاق 450 درجة مئوية ناتجة عن جفاف Ca(OH)2. لمزيد من التفسيرات لخطوات فقدان الكتلة، من الواضح أن تحليل الغاز المتطور سيكون مفيدًا [8]. كما أن نتيجة DSC عند درجة حرارة أعلى من 580 درجة مئوية تقريبًا معقدة للغاية (انظر الشكل 5ب): تم اكتشاف ما لا يقل عن سبعة تأثيرات ماصة للحرارة في التذبذب الحراري الحراري المانع للحرارة. ومن المرجح أن تكون القمة الرئيسية عند درجة 799 درجة مئوية ناتجة عن خليط ثنائي غني بكلوريد الصوديوم مثل NaI-NaCl أو كلوريد الكالسيوم-كلوريد الصوديوم [7] أو Na2CO3- NaCl [7، 9]، حيث قد تنشأ أيضًا قمة التذبذب الحراري الدوراني الحراري عند 712 درجة مئوية. من المفترض أن تكون تأثيرات DSC المتبقية بين 580 درجة مئوية و720 درجة مئوية ناتجة عن عمليات ذوبان العديد من اليوديدات والفلوريدات والكلوريدات والكربونات أو الكبريتات ومخاليطها مع كلوريد الصوديوم أو كلوريد الكالسيوم [7، 10]. على سبيل المثال، قد ترجع ذروة DSC عند 587 درجة مئوية إلى CaI2 أو K2SO4، وقد ترجع الذروة الحادة عند 690 درجة مئوية إلى KI، وقد ترجع الذروة عند 679 درجة مئوية إلى التحول الهيكلي لـ Fe2O3 [10]. يمكن رؤية المزيد من التفاصيل مثل درجات حرارة الذروة والإنثالبي مرة أخرى في الشكل 5ب. إن فقدان الكتلة لملح الهيمالايا بنسبة 2.74% فوق 700 درجة مئوية (انظر الشكل 5أ)، والذي يرجع مرة أخرى إلى التبخر الجزئي، أعلى بكثير من العينات الأخرى التي تم فحصها.
الخاتمة
أثبتت فحوصات كلوريد الصوديوم وكلوريد الكالسيوم وملح الطعام وملح الهيمالايا بواسطة STA 449 F5 Jupiter® أن هذه الأداة مناسبة تمامًا لدراسة مواد مثل الأملاح القلوية ومخاليطها. وتسمح إشارة DSC على وجه الخصوص، التي تعكس بوضوح شديد عمليات الذوبان والتحولات الطورية الأخرى، بالتحقيق في مخططات الطور من خلال درجات حرارة الذوبان وحتى الإنثالبي. لا تشير إشارة TGA ليس فقط إلى تبخر العينة ولكن أيضًا إلى خطوات فقدان الكتلة بسبب تحلل المواد الشائبة، على سبيل المثال، والتي يمكن تحديدها وقياسها في العديد من الحالات.