Introdução

Embora técnicas analíticas como EDX ou ICP-MS forneçam uma análise detalhada de elementos químicos, por exemplo, daqueles que ocorrem em uma amostra de sal [1], os métodos de análise térmica também podem ser usados para identificar e caracterizar diferentes compostos químicos presentes em tal amostra. A análise térmica simultânea (STA), que se refere à termogravimetria (TGA) e à calorimetria diferencial de varredura (DSC) realizadas simultaneamente em um único experimento, foi, por exemplo, empregada para investigar matérias-primas de cimento, incluindo a presença e o impacto de impurezas de sais de metais alcalinos [2]. Outro exemplo é o processo deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão e a capacidade de calor específica do material de mudança de fase (PCM) nitrato de sódio, NaNO3, que foi estudado por meio de DSC [3].
Este trabalho trata de medições de STA em NaCl, KCl, sal de mesa comum e o chamado sal do Himalaia, em que o foco é aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão, a evaporação parcial e a análise da composição dos sais. Os sais alcalinos, como o NaCl (halita) e o KCl (silvita), desempenham um papel importante em nossa vida cotidiana. Enquanto o NaCl é o principal componente do sal de cozinha ou de mesa, o KCl pode, por exemplo, ser usado como sal de estrada no inverno. O sal do Himalaia, originário do Paquistão, é um sal natural que contém - junto com o NaCl - vários minerais e óxidos como o Fe2O3 [1], responsável pela cor levemente rosada (veja a foto acima).
Experimental
As medições foram realizadas com o STA 449 F5 Jupiter® (veja a figura 1). Esse instrumento, que tem um forno de SiC que permite uma temperatura máxima de amostra de 1600°C, pode ser equipado opcionalmente com o trocador automático de amostras (ASC) e técnicas de acoplamento para análise de gás evoluído, como MS, FT-IR ou GC-MS. A faixa de pesagem da balança é de até 35 g, com uma resolução de 0,1 μg em toda a faixa. Outra vantagem do STA 449 F5 Jupiter® é a funcionalidade do software TG-BeFlat® que leva automaticamente em conta o efeito de flutuação, de modo que as medições de linha de base não são mais necessárias para testes padrão.

As condições de medição aplicadas para este trabalho estão resumidas na tabela 1.
Tabela 1: Condições de medição aplicadas a este trabalho
Condições de medição | |
|---|---|
| Instrumento | STA 449 F5 Jupiter® |
| Suporte de amostras | TGA-DSC tipo S |
| Cadinhos | PtRh (0,19 ml) |
| Taxa de aquecimento | 10 K/min |
| Massas das amostras | 23 ± 1 mg |
| Atmosfera | N2 |
| Vazão de gás de purga | 70 ml/min |
As amostras de NaCl [4] e KCl [5] tinham purezas nominais de 99,8%, enquanto não havia informações sobre a pureza do sal de mesa e do sal do Himalaia. Todas as amostras foram medidas como uma fina camada de grãos cobrindo apenas o fundo do cadinho; o material da amostra não foi moído nem compactado.
Resultados e discussão
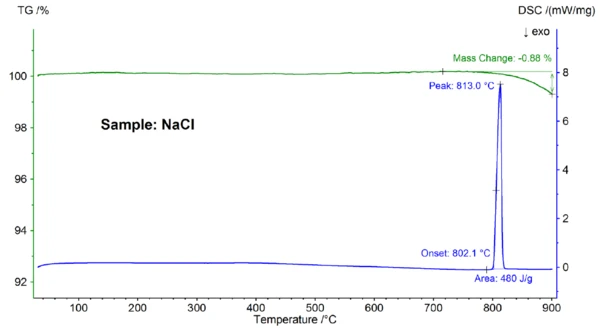
A figura 2 mostra a mudança de massa dependente da temperatura e a taxa de fluxo de calor da amostra de NaCl. Em uma temperatura de início extrapolada de 802,1 °C, foi observado um efeito EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico com uma temperatura de pico de 813 °C e uma entalpia de 480 J/g, que pode ser atribuída à fusão da amostra. A temperatura de início, que reflete o Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão, corresponde bem ao valor da literatura de 801°C; a entalpia de 480 J/g também está de acordo com o valor do calor deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão de 484 J/g encontrado na literatura [6]. Acima de aproximadamente 800°C, ocorreu uma perda de massa de 0,9%, que se deve à evaporação parcial da amostra.
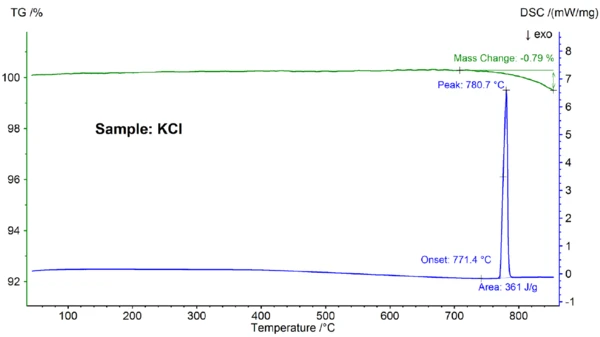
Os resultados da STA para a amostra de KCl são mostrados na figura 3. Novamente, foram observadasTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão e evaporação parcial; o Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão, detectado a 771,4 °C, está de acordo com o valor de 772 °C da literatura e o valor de entalpia de 361 J/g está novamente de acordo com o valor de 351 J/g relatado na referência [6].
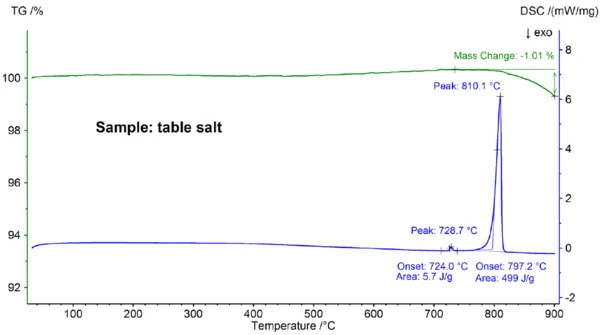
Na figura 4, são exibidos os resultados de STA obtidos para a amostra de sal de mesa, que diferem claramente dos resultados obtidos para a amostra de NaCl puro (compare as figuras 4 e 2): O início do pico principal de DSC está em 797,2°C e, portanto, significativamente abaixo do valor de 802,1°C observado para NaCl puro; além disso, um efeito EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico adicional foi detectado em uma temperatura de início extrapolada de 724°C. A entalpia do efeito deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão principal de 499 J/g está na mesma faixa do valor de 480 J/g observado para o NaCl puro, enquanto a entalpia do primeiro efeito é de apenas 6 J/g. Esses resultados demonstram que o sal de mesa - como esperado - não é NaCl puro; a curva DSC encontrada para a amostra de sal de mesa é normalmente observada para misturas binárias de sal [7]. Nesse caso, o NaI-NaCl com uma concentração de NaI na faixa de porcentagem mais baixa é o candidato mais provável [7].
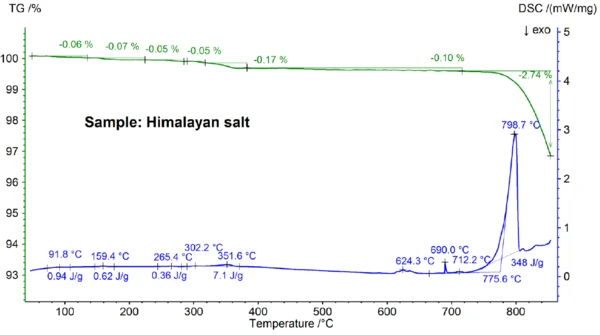
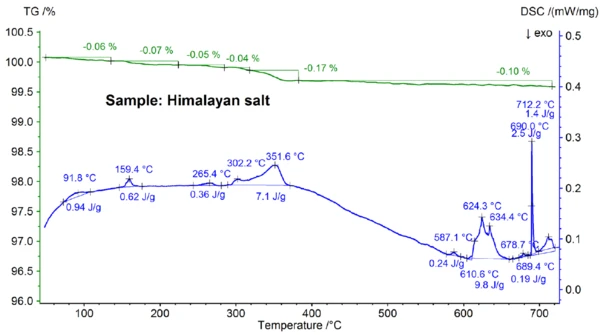
Os resultados de STA obtidos para o sal do Himalaia mostrados nas figuras 5a e 5b são ainda mais complexos do que os resultados para o sal de mesa. Isso já pode ser visto nas etapas de perda de massa de 0,06%, 0,07%, 0,05%, 0,05%, 0,17% e 0,10% observadas abaixo de 700°C apenas para a amostra de sal do Himalaia (veja a figura 5b). Abaixo de aproximadamente 400°C, o sinal DSC mostrou efeitos endotérmicos que se correlacionam - e que são devidos às etapas de perda de massa; detalhes como temperaturas de pico e entalpias podem ser vistos na figura 5b. A perda de massa abaixo de cerca de 200°C provavelmente se deve à liberação de umidade e à desidratação do gesso (mistura de CaSO4∙2H2Oe CaSO4∙½H2O) com uma concentração estimada na faixa de sub porcentagem. Entre aproximadamente 200°C e 400°C, as etapas de perda de massa podem ser devidas à Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição de vários carbonatos, enquanto a etapa de perda de massa na faixa de 450°C pode ser devida à desidratação do Ca(OH)2. Para interpretações adicionais das etapas de perda de massa, a análise de gás evoluído seria claramente útil [8]. O resultado de DSC acima de aproximadamente 580°C também é muito complexo (veja a figura 5b): Foram detectados pelo menos sete efeitos endotérmicos de DSC. O pico principal a 799°C é, mais uma vez, provavelmente devido a uma mistura binária rica em NaCl, como NaI-NaCl, KCl-NaCl [7] ou Na2CO3- NaCl [7, 9], de onde o pico de DSC a 712°C também pode se originar. Os efeitos DSC restantes entre 580°C e 720°C são presumivelmente devidos aos processos de fusão de vários iodetos, fluoretos, cloretos, carbonatos ou sulfatos e misturas deles com NaCl ou KCl [7, 10]. Por exemplo, o pico de DSC a 587°C pode ser devido a CaI2 ou K2SO4, o pico acentuado a 690°C pode ser devido a KI e o pico a 679°C pode ser devido a uma transformação estrutural de Fe2O3 [10]. Mais detalhes, como temperaturas de pico e entalpias, podem ser vistos novamente na figura 5b. A perda de massa do sal do Himalaia de 2,74% acima de 700°C (veja a figura 5a), que novamente se deve à evaporação parcial, é significativamente maior do que a das outras amostras investigadas.
Conclusão
As investigações de NaCl, KCl, sal de mesa e sal do Himalaia por meio do STA 449 F5 Jupiter® demonstraram que esse instrumento é adequado para o estudo de substâncias como sais alcalinos e suas misturas. Especialmente o sinal de DSC, que reflete com muita clareza os processos de fusão e outras transformações de fase, permite a investigação de diagramas de fase por meio de temperaturas de fusão e até mesmo entalpias. O sinal de TGA indica não apenas a evaporação da amostra, mas também as etapas de perda de massa devido à Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição de, por exemplo, substâncias de impureza que podem ser identificadas e quantificadas em vários casos.