Giriş

EDX veya ICP-MS gibi analitik teknikler, örneğin bir tuz örneğinde bulunan kimyasal elementlerin ayrıntılı analizini sağlarken [1], termal analiz yöntemleri de böyle bir örnekte bulunan farklı kimyasal bileşikleri tanımlamak ve karakterize etmek için kullanılabilir. Tek bir deneyde eş zamanlı olarak gerçekleştirilen termogravimetri (TGA) ve diferansiyel taramalı kalorimetri (DSC) anlamına gelen eş zamanlı termal analiz (STA), örneğin alkali metal tuzu safsızlıklarının varlığı ve etkisi de dahil olmak üzere çimento hammaddelerini araştırmak için kullanılmıştır [2]. Bir başka örnek ise DSC ile incelenen faz değişim malzemesi (PCM) sodyum nitratın (NaNO3) erime süreci ve özgül ısı kapasitesidir [3].
Bu çalışma, NaCl, KCl, normal sofra tuzu ve Himalaya tuzu olarak adlandırılan tuzlarınErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime, kısmi BuharlaşmaBir elementin veya bileşiğin buharlaşması, sıvı fazdan buhara bir faz geçişidir. İki tür buharlaşma vardır: buharlaşma ve kaynama.buharlaşma ve bileşimsel analizlerinin odak noktası olduğu STA ölçümlerini ele almaktadır. NaCl (halit) ve KCl (silvit) gibi alkali tuzlar günlük hayatımızda önemli bir rol oynamaktadır. NaCl sofra veya yemek tuzunun ana bileşeniyken, KCl örneğin kışın yol tuzu olarak kullanılabilir. Pakistan kökenli Himalaya tuzu, NaCl ile birlikte Fe2O3 [1] gibi çeşitli mineraller ve oksitler içeren doğal bir tuzdur ve hafif pembe renginden sorumludur (yukarıdaki fotoğrafa bakınız).
Deneysel
Ölçümler STA 449 F5 Jupiter® (bkz. Şekil 1) kullanılarak gerçekleştirilmiştir. Maksimum 1600°C numune sıcaklığına izin veren bir SiC fırına sahip olan bu cihaz, isteğe bağlı olarak otomatik numune değiştirici (ASC) ve MS, FT-IR veya GC-MS gibi evrimleşmiş gaz analizi için birleştirme teknikleri ile donatılabilir. Terazinin tartım aralığı, tüm aralıkta 0,1 μg terazi çözünürlüğü ile 35 g kadar geniştir. STA 449 F5 Jupiter® cihazının bir diğer avantajı da kaldırma kuvveti etkisini otomatik olarak hesaba katan TG-BeFlat® yazılım işlevselliğidir, böylece standart testler için başlangıç ölçümleri artık gerekli değildir.

Bu çalışma için uygulanan ölçüm koşulları Tablo 1'de özetlenmiştir.
Tablo 1: Bu çalışma için uygulanan ölçüm koşulları
Ölçüm Koşulları | |
|---|---|
| Enstrüman | STA 449 F5 Jupiter® |
| Örnek taşıyıcı | TGA-DSC tip S |
| Potalar | PtRh (0,19 ml) |
| Isıtma Oranı | 10 K/dak |
| Örnek kütleler | 23 ± 1 mg |
| Atmosfer | N2 |
| Tahliye gazı akış hızı | 70 ml/dak |
NaCl [4] ve KCl [5] numunelerinin her ikisi de %99,8 nominal saflığa sahipken, sofra tuzu ve Himalaya tuzu için saflığa ilişkin herhangi bir bilgi mevcut değildir. Tüm numuneler krozenin tabanını kaplayan ince bir tane tabakası olarak ölçülmüştür; numune malzemesi ne öğütülmüş ne de sıkıştırılmıştır.
Sonuçlar ve Tartışma
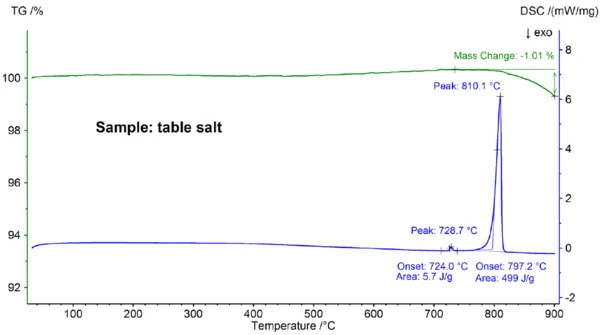
Şekil 2'de NaCl numunesinin sıcaklığa bağlı kütle değişimi ve ısı akış hızı gösterilmektedir. Tahmin edilen 802,1°C başlangıç sıcaklığında, numunenin erimesine atfedilebilecek 813°C tepe sıcaklığı ve 480 J/g entalpi ile EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik bir etki gözlenmiştir. Erime noktasını yansıtan başlangıç sıcaklığı, 801°C'lik literatür değeriyle iyi bir uyum içindedir; 480 J/g'lık entalpi de literatürde bulunan 484 J/g'lık füzyon ısısı değeriyle iyi bir uyum içindedir [6]. Yaklaşık 800°C'nin üzerinde, numunenin kısmi buharlaşmasından kaynaklanan %0,9'luk bir kütle kaybı meydana gelmiştir.
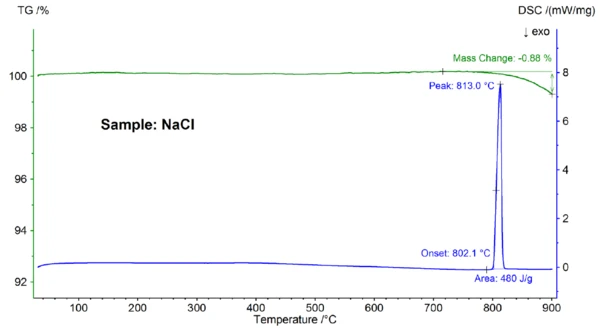
KCl numunesi için STA sonuçları Şekil 3'te gösterilmektedir. YineErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime ve kısmi BuharlaşmaBir elementin veya bileşiğin buharlaşması, sıvı fazdan buhara bir faz geçişidir. İki tür buharlaşma vardır: buharlaşma ve kaynama.buharlaşma gözlenmiştir; 771,4°C'de tespit edilenErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime noktası, 772°C'lik literatür değeriyle iyi bir uyum içindedir ve 361 J/g'lık entalpi değeri yine referansta bildirilen 351 J/g değeriyle uyumludur [6].
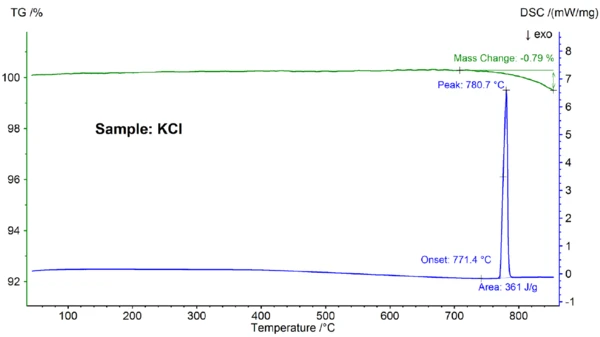
Şekil 4'te sofra tuzu numunesi için elde edilen ve saf NaCl numunesi için elde edilen sonuçlardan açıkça farklı olan STA sonuçları gösterilmektedir (şekil 4 ve 2'yi karşılaştırın): Ana DSC pikinin başlangıcı 797,2°C'de ve dolayısıyla saf NaCl için gözlemlenen 802,1°C değerinin önemli ölçüde altındadır; ayrıca, 724°C'lik ekstrapole edilmiş bir başlangıç sıcaklığında ek bir EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik etki tespit edilmiştir. AnaErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime etkisinin entalpisi olan 499 J/g, saf NaCl için gözlemlenen 480 J/g değeriyle aynı aralıktayken, ilk etkinin entalpisi sadece 6 J/g'dır. Bu sonuçlar sofra tuzunun - beklendiği gibi - saf NaCl olmadığını göstermektedir; sofra tuzu örneği için bulunan DSC eğrisi tipik olarak ikili tuz karışımları için gözlenmektedir [7]. Bu durumda, düşük yüzde aralığında NaI konsantrasyonuna sahip NaI-NaCl en olası adaydır [7].
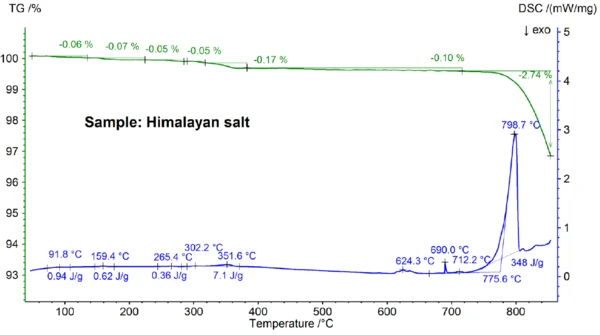
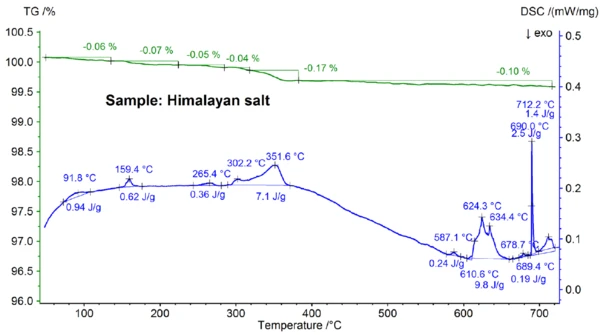
Şekil 5a ve 5b'de gösterilen Himalaya tuzu için elde edilen STA sonuçları sofra tuzu için elde edilen sonuçlardan daha da karmaşıktır. Bu durum, sadece Himalaya tuzu örneği için 700°C'nin altında gözlemlenen %0,06, %0,07, %0,05, %0,05, %0,17 ve %0,10'luk kütle kaybı adımlarında görülebilir (bkz. şekil 5b). Yaklaşık 400°C'nin altında DSC sinyali, kütle kaybı adımlarıyla ilişkili EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik etkiler göstermiştir; tepe sıcaklıkları ve entalpiler gibi ayrıntılar şekil 5b'de görülebilir. Yaklaşık 200°C'nin altındaki kütle kaybı büyük olasılıkla nem salınımı ve alçıtaşının (CaSO4∙2H2Ove CaSO4∙½H2Okarışımı) dehidrasyonundan kaynaklanmaktadır ve tahmini konsantrasyon yüzde alt aralığındadır. Yaklaşık 200°C ile 400°C arasındaki kütle kaybı adımları çeşitli karbonatların ayrışmasından kaynaklanabilirken, 450°C aralığındaki kütle kaybı adımı Ca(OH)2'nin dehidrasyonundan kaynaklanıyor olabilir. Kütle kaybı adımlarının daha fazla yorumlanması için, evrimleşmiş gaz analizi açıkça yardımcı olacaktır [8]. Yaklaşık 580°C'nin üzerindeki DSC sonucu da çok karmaşıktır (bkz. Şekil 5b): En az yedi EndotermikBir örnek geçişi veya bir reaksiyon, dönüşüm için ısı gerekiyorsa endotermiktir.endotermik DSC etkisi tespit edilmiştir. 799°C'deki ana pik yine büyük olasılıkla NaI-NaCl, KCl-NaCl [7] veya Na2CO3- NaCl [7, 9] gibi ikili, NaCl bakımından zengin bir karışımdan kaynaklanmaktadır ve 712°C'deki DSC piki de buradan kaynaklanıyor olabilir. 580°C ile 720°C arasında kalan DSC etkileri muhtemelen çeşitli iyodürlerin, florürlerin, klorürlerin, karbonatların veya sülfatların ve bunların NaCl veya KCl ile karışımlarınınErime Sıcaklıkları ve EntalpileriGizli ısı olarak da bilinen bir maddenin füzyon entalpisi, bir maddeyi katı halden sıvı hale dönüştürmek için gerekli olan enerji girdisinin, tipik olarak ısının bir ölçüsüdür. Bir maddenin erime noktası, katı (kristal) halden sıvı (izotropik eriyik) hale geçtiği sıcaklıktır. erime süreçlerinden kaynaklanmaktadır [7, 10]. Örneğin, 587°C'deki DSC piki CaI2 veya K2SO4'ten, 690°C'deki keskin pik KI'den ve 679°C'deki pik Fe2O3 'ün yapısal dönüşümünden kaynaklanıyor olabilir [10]. Pik sıcaklıkları ve entalpiler gibi daha fazla ayrıntı yine şekil 5b'de görülebilir. Himalaya tuzunun 700°C'nin üzerindeki %2,74'lük kütle kaybı (bkz. Şekil 5a), yine kısmi buharlaşmadan kaynaklanmaktadır ve incelenen diğer numunelerden önemli ölçüde daha yüksektir.
Sonuç
NaCl, KCl, sofra tuzu ve Himalaya tuzunun STA 449 F5 Jupiter® ile incelenmesi, bu cihazın alkali tuzlar ve bunların karışımları gibi maddelerin incelenmesi için çok uygun olduğunu göstermiştir. Özellikle erime süreçlerini ve diğer faz dönüşümlerini çok net bir şekilde yansıtan DSC sinyali, erime sıcaklıkları ve hatta entalpiler aracılığıyla faz diyagramlarının incelenmesine olanak tanır. TGA sinyali sadece numunenin buharlaşmasını değil, aynı zamanda örneğin birçok durumda tanımlanabilen ve nicelendirilebilen safsızlık maddelerinin ayrışması nedeniyle kütle kaybı adımlarını da gösterir.