Wprowadzenie

Podczas gdy techniki analityczne, takie jak EDX lub ICP-MS, zapewniają szczegółową analizę pierwiastków chemicznych, np. tych występujących w próbce soli [1], metody analizy termicznej mogą być również wykorzystywane do identyfikacji i charakterystyki różnych związków chemicznych obecnych w takiej próbce. Jednoczesna analiza termiczna (STA), która odnosi się do termograwimetrii (TGA) i różnicowej kalorymetrii skaningowej (DSC) wykonywanych jednocześnie w jednym eksperymencie, została na przykład wykorzystana do badania surowców cementowych, w tym obecności i wpływu zanieczyszczeń soli metali alkalicznych [2]. Innym przykładem jest proces topnienia iPojemność cieplna właściwa (cp)Pojemność cieplna jest wielkością fizyczną specyficzną dla materiału, określoną przez ilość ciepła dostarczonego do próbki, podzieloną przez wynikający z tego wzrost temperatury. Pojemność cieplna właściwa jest związana z jednostką masy próbki. pojemność cieplna właściwa materiału przemiany fazowej (PCM) azotanu sodu, NaNO3, który badano za pomocą DSC [3].
Niniejsza praca dotyczy pomiarów STA dla NaCl, KCl, zwykłej soli kuchennej i tak zwanej soli himalajskiej, gdzie skupiono się na topnieniu, częściowym odparowaniu i analizie składu soli. Sole alkaliczne, takie jak NaCl (halit) i KCl (sylvit), odgrywają ważną rolę w naszym codziennym życiu. Podczas gdy NaCl jest głównym składnikiem soli kuchennej lub stołowej, KCl może być na przykład stosowany jako sól drogowa w zimie. Sól himalajska pochodząca z Pakistanu jest naturalną solą, która zawiera - wraz z NaCl - różne minerały i tlenki, takie jak Fe2O3 [1], które są odpowiedzialne za lekko różowy kolor (patrz zdjęcie powyżej).
Eksperymentalny
Pomiary przeprowadzono przy użyciu urządzenia STA 449 F5 Jupiter® (patrz rysunek 1). Urządzenie to, wyposażone w piec SiC umożliwiający uzyskanie maksymalnej temperatury próbki 1600°C, może być opcjonalnie wyposażone w automatyczny zmieniacz próbek (ASC) i techniki sprzęgania do analizy gazów wydzielających się, takie jak MS, FT-IR lub GC-MS. Zakres ważenia wagi wynosi aż 35 g z rozdzielczością 0,1 μg w całym zakresie. Kolejną zaletą wagi STA 449 F5 Jupiter® jest funkcja oprogramowania TG-BeFlat®, która automatycznie uwzględnia efekt wyporu, dzięki czemu pomiary bazowe nie są już konieczne w przypadku standardowych testów.

Warunki pomiarowe zastosowane w tej pracy podsumowano w tabeli 1.
Tabela 1: Warunki pomiarowe zastosowane w niniejszej pracy
Warunki pomiaru | |
|---|---|
| Przyrząd | STA 449 F5 Jupiter® |
| Nośnik próbki | TGA-DSC typ S |
| Tygle | PtRh (0,19 ml) |
| Szybkość ogrzewania | 10 K/min |
| Masa próbki | 23 ± 1 mg |
| Atmosfera | N2 |
| Natężenie przepływu gazu oczyszczającego | 70 ml/min |
Próbki NaCl [4] i KCl [5] miały nominalną czystość 99,8%, podczas gdy nie było dostępnych informacji dotyczących czystości soli kuchennej i himalajskiej. Wszystkie próbki zostały zmierzone jako cienka warstwa ziaren pokrywająca dno tygla; materiał próbki nie został zmielony ani zagęszczony.
Wyniki i dyskusja
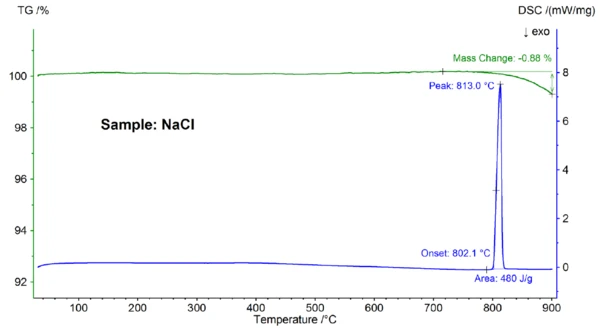
Na rysunku 2 przedstawiono zależną od temperatury zmianę masy i natężenie przepływu ciepła próbki NaCl. Przy ekstrapolowanej temperaturze początkowej 802,1°C zaobserwowano efekt EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny z temperaturą szczytową 813°C i entalpią 480 J/g, co można przypisać topnieniu próbki. Temperatura początku, która odzwierciedla temperaturę topnienia, dobrze pasuje do wartości literaturowej 801°C; entalpia 480 J/g jest również w dobrej zgodności z wartością ciepła topnienia 484 J/g znalezioną w literaturze [6]. Powyżej około 800°C nastąpiła utrata masy wynosząca 0,9%, co jest spowodowane częściowym odparowaniem próbki.
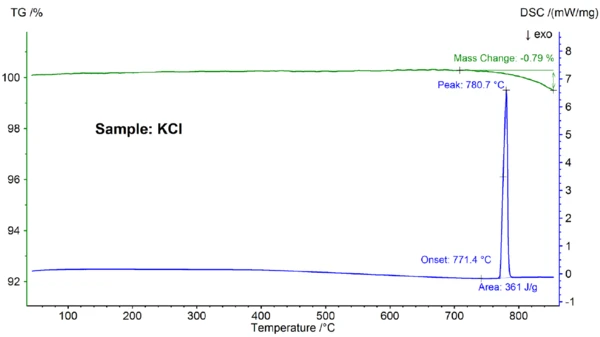
Wyniki STA dla próbki KCl pokazano na rysunku 3. Ponownie zaobserwowanoTemperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo). topnienie i częściowe OdparowanieOdparowanie pierwiastka lub związku jest przejściem fazowym z fazy ciekłej do pary. Istnieją dwa rodzaje parowania: parowanie i wrzenie.odparowanie; Temperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo).temperatura topnienia, wykryta w 771,4°C, jest zgodna z wartością literaturową 772°C, a wartość entalpii 361 J/g jest ponownie zgodna z wartością 351 J/g podaną w referencji [6].
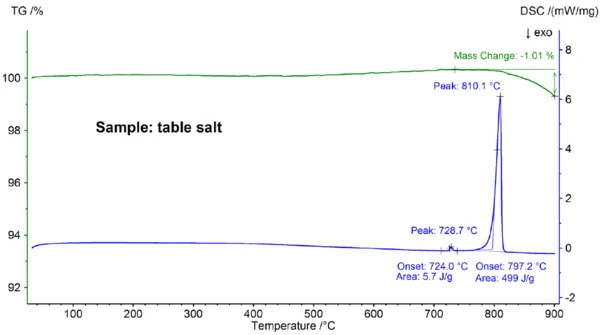
Na rysunku 4 przedstawiono wyniki STA uzyskane dla próbki soli kuchennej, które wyraźnie różnią się od wyników uzyskanych dla próbki czystego NaCl (porównaj rysunki 4 i 2): Początek głównego piku DSC znajduje się w temperaturze 797,2°C, a zatem znacznie poniżej wartości 802,1°C obserwowanej dla czystego NaCl; wykryto również dodatkowy efekt EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny w ekstrapolowanej temperaturze początku 724°C. Entalpia głównego efektu topnienia 499 J/g jest w tym samym zakresie, co wartość 480 J/g obserwowana dla czystego NaCl, podczas gdy entalpia pierwszego efektu wynosi tylko 6 J/g. Wyniki te pokazują, że sól kuchenna nie jest - zgodnie z oczekiwaniami - czystym NaCl; krzywa DSC znaleziona dla próbki soli kuchennej jest zwykle obserwowana dla dwuskładnikowych mieszanin soli [7]. W tym przypadku najbardziej prawdopodobnym kandydatem jest NaI-NaCl o stężeniu NaI w niższym zakresie procentowym [7].
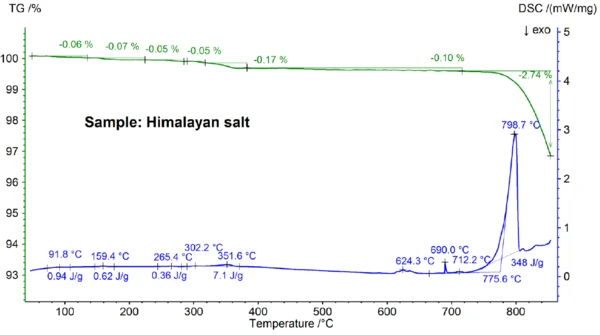
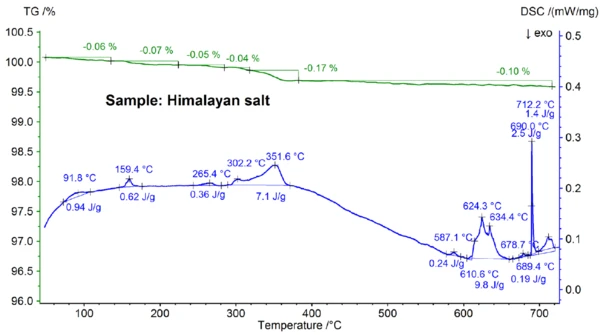
Wyniki STA uzyskane dla soli himalajskiej pokazane na rysunkach 5a i 5b są jeszcze bardziej złożone niż wyniki dla soli kuchennej. Widać to już w stopniach utraty masy 0,06%, 0,07%, 0,05%, 0,05%, 0,17% i 0,10% obserwowanych poniżej 700°C tylko dla próbki soli himalajskiej (patrz rysunek 5b). Poniżej około 400°C sygnał DSC wykazał efekty endotermiczne, które korelują - i które są spowodowane etapami utraty masy; szczegóły, takie jak temperatury szczytowe i entalpie można zobaczyć na rysunku 5b. Utrata masy poniżej około 200°C jest najprawdopodobniej spowodowana uwolnieniem wilgoci i odwodnieniem gipsu (mieszaniny CaSO4∙2H2Oi CaSO4∙½H2O) o szacowanym stężeniu w zakresie poniżej procenta. Pomiędzy około 200°C a 400°C, etapy utraty masy mogą być spowodowane rozkładem różnych węglanów, podczas gdy etap utraty masy w zakresie 450°C może być spowodowany odwodnieniem Ca(OH)2. W celu dalszej interpretacji etapów utraty masy pomocna byłaby analiza wydzielonego gazu [8]. Wynik DSC w temperaturze powyżej około 580°C jest również bardzo złożony (patrz rysunek 5b): Wykryto co najmniej siedem endotermicznych efektów DSC. Główny pik w temperaturze 799°C jest najprawdopodobniej spowodowany dwuskładnikową mieszaniną bogatą w NaCl, taką jak NaI-NaCl, KCl-NaCl [7] lub Na2CO3-NaCl[7, 9], z której może również pochodzić pik DSC w temperaturze 712°C. Pozostałe efekty DSC w zakresie od 580°C do 720°C są prawdopodobnie spowodowane procesami topnienia kilku jodków, fluorków, chlorków, węglanów lub siarczanów oraz ich mieszanin z NaCl lub KCl [7, 10]. Na przykład pik DSC w 587°C może być spowodowany przez CaI2 lub K2SO4, ostry pik w 690°C może być spowodowany przez KI, a pik w 679°C może być spowodowany transformacją strukturalną Fe2O3 [10]. Dalsze szczegóły, takie jak szczytowe temperatury i entalpie, można ponownie zobaczyć na rysunku 5b. Utrata masy soli himalajskiej wynosząca 2,74% powyżej 700°C (patrz rysunek 5a), która jest ponownie spowodowana częściowym odparowaniem, jest znacznie wyższa niż w przypadku innych badanych próbek.
Wnioski
Badania NaCl, KCl, soli kuchennej i soli himalajskiej za pomocą STA 449 F5 Jupiter® wykazały, że urządzenie to dobrze nadaje się do badania substancji takich jak sole alkaliczne i ich mieszaniny. W szczególności sygnał DSC, który bardzo wyraźnie odzwierciedla procesy topnienia i inne przemiany fazowe, pozwala na badanie diagramów fazowych za pomocą temperatur topnienia, a nawet entalpii. Sygnał TGA wskazuje nie tylko parowanie próbki, ale także etapy utraty masy spowodowane rozkładem, na przykład, substancji zanieczyszczających, które można zidentyfikować i określić ilościowo w kilku przypadkach.