Введение

В то время как такие аналитические методы, как EDX или ICP-MS, обеспечивают детальный анализ химических элементов, например, тех, которые присутствуют в образце соли [1], методы термического анализа также могут быть использованы для идентификации и определения характеристик различных химических соединений, присутствующих в таком образце. Одновременный термический анализ (STA), включающий термогравиметрию (TGA) и дифференциальную сканирующую калориметрию (DSC), одновременно проводимые в одном эксперименте, был, например, использован для исследования цементного сырья, включая наличие и влияние примесей солей щелочных металлов [2]. Другой пример - процесс плавления и удельная теплоемкость фазового материала (ФМ) нитрата натрия, NaNO3, которые были изучены с помощью ДСК [3].
В данной работе рассматриваются измерения ДСК для NaCl, KCl, обычной поваренной соли и так называемой гималайской соли, где основное внимание уделяется плавлению, частичному испарению и анализу состава солей. Щелочные соли, такие как NaCl (галит) и KCl (сильвит), играют важную роль в нашей повседневной жизни. Если NaCl является основным компонентом поваренной или столовой соли, то KCl, например, может использоваться в качестве дорожной соли в зимнее время. Гималайская соль, происходящая из Пакистана, - это натуральная соль, содержащая наряду с NaCl различные минералы и оксиды, например Fe2O3 [1], который отвечает за слегка розовый цвет (см. фото выше).
Экспериментальный
Измерения проводились на приборе STA 449 F5 Jupiter® (см. рис. 1). Этот прибор, оснащенный SiC-печью, обеспечивающей максимальную температуру образца 1600°C, может быть дополнительно оснащен автоматическим устройством смены образцов (ASC) и методами сопряжения для анализа растворенных газов, такими как MS, FT-IR или GC-MS. Диапазон взвешивания весов достигает 35 г, при этом разрешение весов составляет 0,1 мкг во всем диапазоне. Еще одним преимуществом STA 449 F5 Jupiter® является функциональность программного обеспечения TG-BeFlat®, которое автоматически учитывает эффект плавучести, так что для стандартных тестов больше не нужны базовые измерения.

Условия измерений, использованные в данной работе, приведены в таблице 1.
Таблица 1: Условия измерений, использованные в данной работе
Условия измерения | |
|---|---|
| Прибор | STA 449 F5 Jupiter® |
| Носитель образца | TGA-DSC тип S |
| Крусиблы | PtRh (0,19 мл) |
| Скорость нагрева | 10 К/мин |
| Масса образца | 23 ± 1 мг |
| Атмосфера | N2 |
| Скорость потока продувочного газа | 70 мл/мин |
Образцы NaCl [4] и KCl [5] имели номинальную чистоту 99,8%, тогда как для поваренной и гималайской соли информации о чистоте не было. Все образцы были измерены в виде тонкого слоя зерен, покрывающего дно тигля; материал образца не измельчался и не уплотнялся.
Результаты и обсуждение
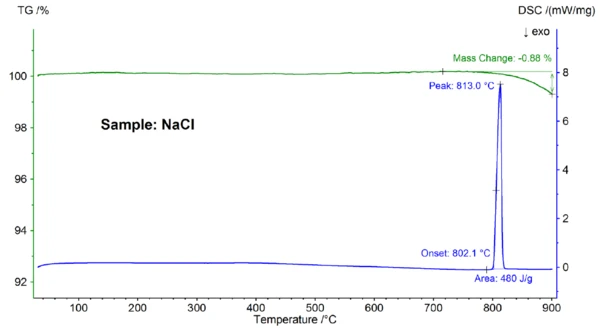
На рисунке 2 показано изменение массы и скорости теплового потока образца NaCl в зависимости от температуры. При экстраполированной температуре начала плавления 802,1°C наблюдается эндотермический эффект с пиковой температурой 813°C и энтальпией 480 Дж/г, который можно отнести к плавлению образца. Температура начала, отражающая точку плавления, хорошо согласуется с литературным значением 801°C; энтальпия 480 Дж/г также хорошо согласуется со значением теплоты плавления 484 Дж/г, найденным в литературе [6]. При температуре выше 800°C произошла потеря массы на 0,9%, что связано с частичным испарением образца.
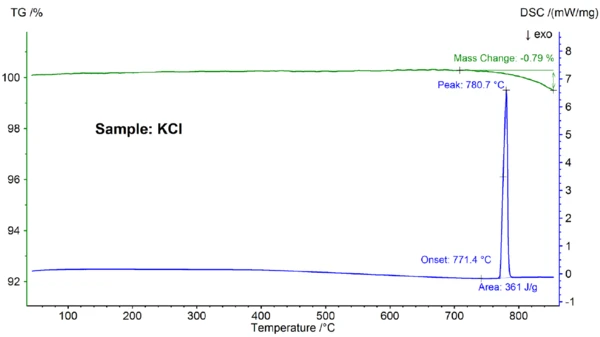
Результаты STA для образца KCl показаны на рисунке 3. Снова наблюдалось плавление и частичное испарение; температура плавления, определенная при 771,4°C, хорошо согласуется с литературным значением 772°C, а значение энтальпии 361 Дж/г снова соответствует значению 351 Дж/г, приведенному в справочнике [6].
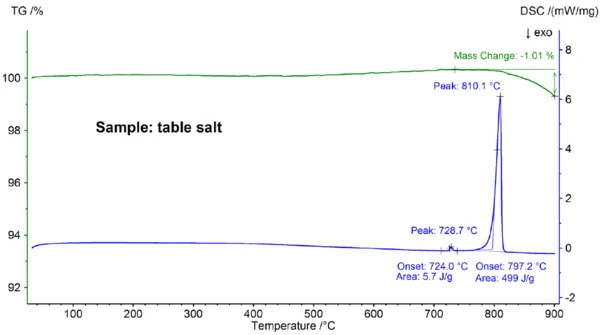
На рисунке 4 представлены результаты ДСК, полученные для образца поваренной соли, которые явно отличаются от результатов, полученных для образца чистого NaCl (сравните рисунки 4 и 2): Начало основного пика ДСК находится при 797,2°C и, таким образом, значительно ниже значения 802,1°C, наблюдаемого для чистого NaCl; также был обнаружен дополнительный эндотермический эффект при экстраполированной температуре начала плавления 724°C. Энтальпия основного эффекта плавления 499 Дж/г находится в том же диапазоне, что и значение 480 Дж/г, наблюдаемое для чистого NaCl, в то время как энтальпия первого эффекта составляет всего 6 Дж/г. Эти результаты показывают, что поваренная соль, как и ожидалось, не является чистым NaCl; кривая ДСК, найденная для образца поваренной соли, обычно наблюдается для бинарных солевых смесей [7]. В этом случае наиболее вероятным кандидатом является NaI-NaCl с концентрацией NaI в нижнем процентном диапазоне [7].
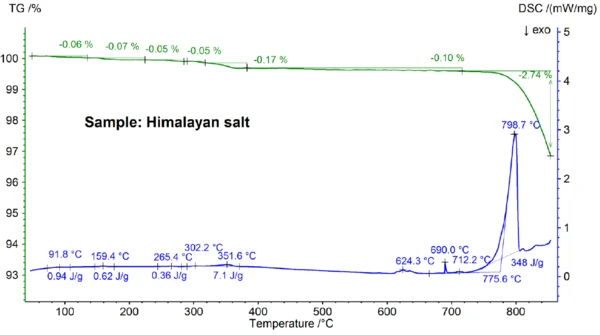
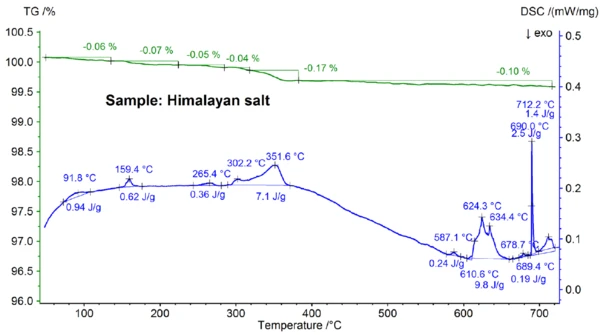
Результаты STA, полученные для гималайской соли, показанные на рисунках 5a и 5b, еще более сложны, чем результаты для поваренной соли. Это видно по ступеням потери массы 0,06%, 0,07%, 0,05%, 0,05%, 0,17% и 0,10%, наблюдаемым ниже 700°C только для образца гималайской соли (см. рис. 5b). Ниже примерно 400°C сигнал ДСК показал эндотермические эффекты, которые коррелируют и обусловлены этапами потери массы; подробности, такие как пиковые температуры и энтальпии, можно увидеть на рисунке 5b. Потеря массы при температуре ниже 200°C, скорее всего, связана с выделением влаги и дегидратацией гипса (смесь CaSO4∙2H2Oи CaSO4∙½H2O) с предполагаемой концентрацией в субпроцентном диапазоне. В диапазоне от 200°C до 400°C ступени потери массы могут быть вызваны разложением различных карбонатов, а ступень потери массы в диапазоне 450°C может быть вызвана дегидратацией Ca(OH)2. Для дальнейшей интерпретации ступеней потери массы, очевидно, будет полезен анализ улетучивающегося газа [8]. Результаты ДСК при температурах выше 580°C также очень сложны (см. рис. 5b): Обнаружено не менее семи эндотермических эффектов ДСК. Основной пик при 799°C, скорее всего, опять же связан с бинарной смесью, богатой NaCl, такой как NaI-NaCl, KCl-NaCl [7] или Na2CO3- NaCl [7, 9], откуда также может происходить пик ДСК при 712°C. Остальные эффекты ДСК между 580 и 720 °С предположительно обусловлены процессами плавления некоторых иодидов, фторидов, хлоридов, карбонатов или сульфатов и их смесей с NaCl или KCl [7, 10]. Например, пик ДСК при 587°C может быть обусловлен CaI2 или K2SO4, резкий пик при 690°C - KI, а пик при 679°C - структурным превращением Fe2O3 [10]. Более подробные данные, такие как температуры и энтальпии пиков, можно увидеть на рисунке 5b. Потеря массы гималайской соли 2,74 % при температуре выше 700 °С (см. рис. 5a), что опять же связано с частичным испарением, значительно выше, чем у других исследованных образцов.
Заключение
Исследования NaCl, KCl, поваренной и гималайской соли с помощью STA 449 F5 Jupiter® показали, что этот прибор хорошо подходит для изучения таких веществ, как щелочные соли и их смеси. В частности, сигнал ДСК, который очень четко отражает процессы плавления и другие фазовые превращения, позволяет исследовать фазовые диаграммы через температуры плавления и даже энтальпии. Сигнал ТГА указывает не только на испарение образца, но и на этапы потери массы в результате разложения, например, примесных веществ, которые в ряде случаев можно идентифицировать и количественно оценить.